QUÍMICA ORGÁNICA
34
¿PODEMOS MEZCLAR ACEITE Y AGUA?
Un hecho conocido por la mayoría de las personas es que el agua y el aceite no se mezclan. De hecho, si colocamos un litro de agua y tratamos de mezclarlo con un litro de aceite comprobaremos que el agua (incolora) se coloca en el fondo y que sobre ella se puede observar el aceite, que lo normal es que tenga color (la palabra aceite se usa para describir un grupo de moléculas, siendo una de las más conocidas el ácido oleico que es el componente principal del aceite de oliva). Aquellos líquidos que no se pueden mezclar se conocen como inmiscibles. En este tipo de mezclas se ha definido como fase orgánica la que contiene al aceite y como fase acuosa la que ocupa el agua. Si hay mucha más agua que aceite se observarán esferas de aceite en la superficie del agua, mientras que si la sustancia que predomina es el aceite se observarán esferas de agua en el fondo.
El hecho de que ambas sustancias no se mezclen tiene una explicación científica bien conocida: se debe a la polaridad de ambos líquidos. La polaridad es una medida de separación de las cargas eléctricas en una molécula (lo que se conoce como densidad de carga positiva o negativa en la molécula). La propiedad que señala si existe o no un desplazamiento de los electrones en una molécula se conoce como momento dipolar. Si el momento dipolar es cero, la molécula será apolar, mientras que cuanto mayor sea el momento dipolar más polar será una molécula.
Si intentamos mezclar agua con aceite nos encontraremos con que no lo hacen. Lo que sucede es que uno de ellos se quedará ocupando la parte superior y el otro la inferior. Por ello, son líquidos inmiscibles. Qué líquido ocupará cada posición vendrá marcado por sus densidades. En el caso del agua y del aceite este último se situará en la parte superior y el agua en la inferior. Two phases (water and oil) in the same state of aggregation (liquid), de Victor Blacus. El archivo se encuentra bajo licencias Creative Commons Attribution-Share Alike 4.0 International, 3.0 Unported, 2.5 Generic, 2.0 Generic y 1.0 Generic.
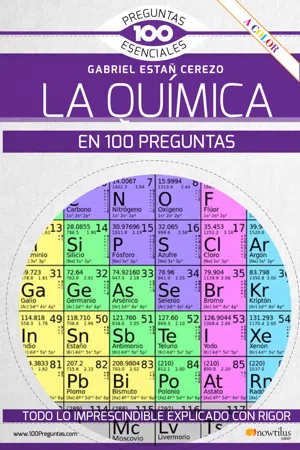
Se presentan las estructuras del dióxido de carbono (izquierda) y del agua (derecha). Las flechas rojas representan hacia dónde se encuentran desplazadas las cargas positivas en los enlaces. En el CO₂ ambas cargas se compensan por la geometría y por ello el momento dipolar es cero, mientras que en el H₂O las dos cargas se encuentran hacia el mismo lado, lo que provoca que se sumen sus efectos y de ahí surge la línea naranja que es la suma de las dos flechas, y para el agua el valor del momento dipolar es de 1,83 D. La unidad que se emplea para medir el momento dipolar es el debye (D).
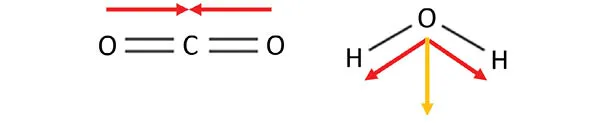
Por ejemplo, las moléculas iónicas tendrán una elevada polaridad ya que en estos enlaces los electrones están claramente desplazados hacia uno de los átomos. Las moléculas orgánicas (en las que los enlaces son mayormente covalentes) pueden ser tanto polares como apolares, pero si nos centramos en los hidrocarburos (sustancias compuestas principalmente por carbono e hidrógeno) el carácter predominante será el apolar. Las moléculas serán más polares cuanto mayor sea la diferencia en electronegatividades de los átomos que las componen. Ahora bien, existen moléculas orgánicas que en función de su geometría pueden o no tener carácter polar. Por ejemplo, el CCl4 será completamente apolar ya que su forma simétrica hace que la separación de cargas se compense, mientras que el CHCl3 sí tendrá una cierta polaridad (ya que los átomos de cloro atraen los electrones con más intensidad que el de hidrógeno).
Estructuras CCl4 (izquierda) y CHCl3 (derecha). Aunque el átomo de hidrógeno esté situado en esa posición las moléculas giran continuamente. Como hemos comentado, al no ser una molécula simétrica y dado que las diferencias entre las electronegatividades del carbono y el cloro son elevadas, los electrones de esos tres enlaces estarán desplazados hacia el cloro y por eso el CHCl3 tiene una cierta polaridad.
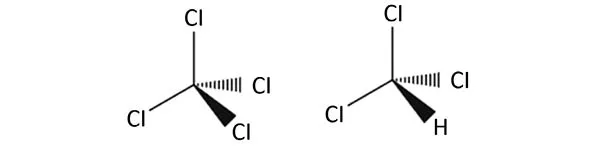
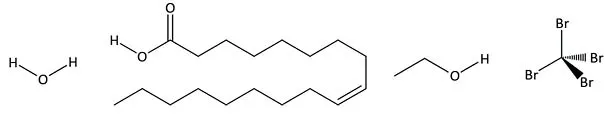
En el caso del agua (H₂O) nos encontramos ante un disolvente polar, ya que los electrones se encuentran desplazados hacia el átomo de oxígeno, que es un átomo muy electronegativo, y por la geometría de este compuesto se obtiene marcado momento dipolar mientras que el aceite tiene carácter apolar. Eso se debe a que está compuesto principalmente por átomos de carbono e hidrógeno cuyas electronegatividades son muy similares, por lo que los electrones están compartidos. Por tanto, ambos no se pueden mezclar y el resto de disolventes actuarán frente a ellos de manera consecuente. Es decir, si se trata de un disolvente polar (como el etanol) se mezclará con el agua y no con el aceite, y si se trata de un disolvente apolar (como el tetrabromuro de carbono) actuará de manera inversa, mezclándose con el aceite y quedando separado del agua.
Se presentan de izquierda a derecha las estructuras del agua (H₂O), ácido oleico, etanol y tetrabromuro de carbono (CBr4). Aunque la estructura del ácido oleico se haya presentado de esa manera, es importante saber que los enlaces simples C-C tienen capacidad de rotar, y por tanto a excepción del doble enlace (C=C), el resto de enlaces de la cadena de carbono pueden moverse y adquirir otras formas.
Esta propiedad es ampliamente utilizada cuando se realiza síntesis orgánica, ya que se emplea para separar compuestos gracias a que hay sustancias que son más solubles en agua mientras que otras lo son en el aceite. De manera general, los compuestos orgánicos (como las grasas y otros aceites) se disolverán mejor en el aceite, y los compuestos que pueden formar iones (como las sales o los ácidos inorgánicos) serán más solubles en el agua. El proceso que se realiza para separar compuestos empleando esta propiedad se conoce como extracción y se utiliza también, por ejemplo, para extraer determinadas sustancias en extractos de plantas.
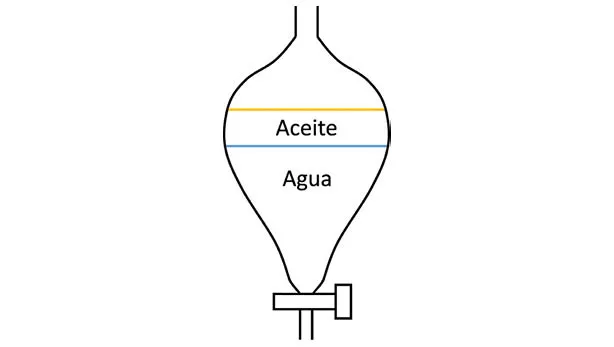
Para poder separar, por ejemplo, los compuestos que se encuentran en una disolución orgánica (ya que buscamos eliminar contaminantes, subproductos, etc.) se emplea un embudo de decantación en el que se vierte la disolución y una porción equivalente de agua. Es importante no llenar demasiado el embudo ya que se debe colocar el tapón y agitar de manera vigorosa para que las moléculas entren en contacto con ambas fases, de manera que puedan acabar en aquella en la que está más favorecida su disolución. Es necesario abrir la válvula cada cierto tiempo mientras se está agitando para evitar una acumulación extra de presión debido a los gases que se generan durante la agitación. Cuando la mezcla ya ha sido suficientemente agitada, se coloca en un soporte y se retira el tapón de la parte superior. De manera que la gravedad procederá a separar ambas fases. La fase que queda en la parte inferior será la que tenga mayor densidad. El agua posee mayor densidad que la mayoría de disolventes orgánicos. Por tanto, lo habitual es que la parte inferior sea ocupada por la fase acuosa. Entonces es posible abrir la válvula inferior y dejar escapar el agua, cerrando la válvula antes de que salga la fase orgánica. Este proceso es habitual repetirlo tres veces para asegurar que la mayoría de compuestos solubles en la fase acuosa han sido eliminados. Hay ocasiones en las que la fase de nuestro interés será la fase acuosa, ya que los compuestos que buscamos purificar son solubles en ella. En ese caso debemos preservar la fase acuosa y desechar la orgánica.
El embudo de decantación es un instrumento fabricado en vidrio transparente muy utilizado en síntesis química. Se coloca sobre un soporte (generalmente un aro que le permite permanecer en posición vertical). Este instrumento es muy importante ya que permite separar fases y, gracias a ello, compuestos que son solubles en un disolvente orgánico apolar (como el aceite) de otros que lo son en un disolvente polar (como el agua). En primer lugar, se tiene que agitar de manera vigorosa. Para ello hay que colocarle el tapón, que quedaría en la parte superior de la imagen cerrando el orificio superior, y cerrar la válvula que se observa en la parte inferior de la imagen. Tras haber agitado durante un intervalo de tiempo, se colocaría de nuevo en la posición inicial, se retiraría el tapón superior y se dejaría que por gravedad ambos disolventes se separasen. Al abrir la válvula inferior el agua caería sobre otro recipiente y podríamos separar ambos disolventes. La operación se repetiría var...