![]()
1. Breve historia de un átomo
Sería muy triste ser un átomo en el universo sin los físicos. Y los físicos están hechos de átomos. Un físico es la forma de un átomo de saber que hay átomos.
George Wald, científico
![]()
El inglés de la manzana y los colores del arcoíris
No hay dudas de que Isaac Newton fue una persona curiosa e inteligente que dejó huella en la historia de la humanidad; sin embargo, a menudo se le atribuyen descubrimientos ajenos que opacan los propios, ciertamente superiores. Un buen ejemplo de ello es la famosa experiencia en la que, gracias a un prisma de vidrio, la luz solar blanca se descompone en los colores del arcoíris. El asunto es que, si bien Newton sin duda lo experimentó muchas veces, estaba reproduciendo una experiencia descubierta en 1611 por Marco Antonio De Dominis, que fuera demostrada e interpretada por otro gran pensador, René Descartes. De hecho, fue Descartes quien en 1637 (cinco años antes del nacimiento de Newton) propuso que la observación de un arcoíris era una consecuencia directa del mismo efecto en el que la luz solar refracta en las gotas de lluvia.
Pero Newton redobló la apuesta en 1665. Preparó su habitación para que se encontrara a oscuras por completo, de modo que permitiera pasar únicamente un rayo de luz solar a través de un agujero en la ventana de su casa materna en Lincolnshire (Inglaterra). Colocó un prisma delante de ese haz, de manera que refractara y se proyectaran los colores del arcoíris en la pared opuesta, a unos 7 metros de distancia (¡vaya habitación la de Isaac!, por cierto, no vivía en un monoambiente).
Lo que deseaba poner a prueba no era la experiencia en sí misma, sino la interpretación que Descartes hizo del fenómeno, pues el francés había postulado que los colores se originaban dentro del prisma, encargado de dar el color a la luz. Al joven Isaac las cosas “no le cerraban”, pues creía que en realidad la luz era una mezcla de todos esos colores, y lo que hacía el prisma era, simplemente, separarlos un poco. Así que usó un segundo prisma por el que fue haciendo pasar los haces de colores, de a uno a la vez. En primer lugar, observó que para cada color el rayo se desviaba de nuevo, pero no cambiaba su tonalidad. Su segunda observación, sin embargo, desató una revolución de ideas: al juntar los distintos colores proyectados en un mismo punto, ¡la luz volvía a ser blanca! El prisma no le daba ninguna nueva propiedad a la luz, sólo se limitaba a descomponerla. Newton tenía razón.
Pero lo que nunca supo don Isaac fue que su descubrimiento formaba parte de un fenómeno mucho más amplio, conocido como “radiación electromagnética”, de la cual la luz visible era simplemente una fracción ínfima. La radiación electromagnética es un fenómeno ondulatorio producido por campos eléctricos que inducen campos magnéticos, que a su vez generan un nuevo campo eléctrico, y este, uno magnético. De este modo, la onda es capaz de propagarse por sus propios medios; además, es la única onda que puede propagarse en el vacío (el resto, como las olas, el sonido o los sismos, necesita de un medio físico).
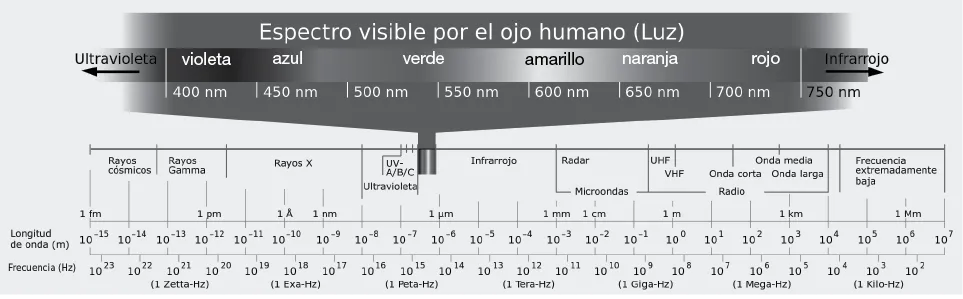
Como toda onda, la radiación electromagnética puede tener una variada gama de longitudes de onda y frecuencias, que se corresponden con el transporte de diferente cantidad de energía. Imaginen una serie de olas que avanzan por el mar: el ancho de la ola corresponderá a la longitud de onda, y su velocidad, a la frecuencia. Mientras que las longitudes de onda grandes son las que poseen menos energía, las de menor valor resultan las más energéticas. La luz es la parte del espectro electromagnético perceptible por nuestra vista, y corresponde a una sección del espectro que tiene longitudes de onda que van desde los 400 nanómetros (correspondiente al color violeta) hasta valores cercanos a los 700 nanómetros (rojo). Eso significa que, al tratarse de una onda de menor longitud, la luz violeta posee más energía que el resto de los colores, y el rojo es el menos energético.
Pero aquí no va eso de “Ojos que no ven, corazón que no siente”, pues el espectro completo de radiación electromagnética tiene muchísimas otras longitudes que quizá nuestros ojos no vean ni sienta nuestro corazón, pero sí lo hará un espectrómetro, instrumento destinado a este tipo de registros. Así puede notarse que la radiación que está antes del color violeta, conocida como “ultravioleta” (UV), posee mucha más energía (y por eso debemos protegernos de buena parte de ella en el verano; no la vemos, pero la sentimos), aunque también existen zonas de longitudes de onda menores (y, por ende, con más energía aún) como son los rayos X, los rayos gamma o incluso los rayos cósmicos. Para el otro lado del espectro visible, tenemos la zona próxima al extremo de color, el rojo, llamada “infrarrojo” (IR), que puede ser percibida por otros seres, como la mayoría de los reptiles, capaces de apreciar la irradiación del calor que emana de nuestro cuerpo justamente dentro de esa frecuencia. Con menos energía aún se encuentran las microondas, que aprovechan con diferente frecuencia tanto los teléfonos celulares como los hornos que hay en nuestras cocinas. Por último, dentro de un rango enorme tenemos la porción de radiación electromagnética con menos energía, las ondas de radio, cuyas longitudes de onda pueden llegar al orden de los kilómetros (imagen 1).
Imagen 1. Espectro electromagnético completo (puede verse ampliada la pequeña fracción del espectro visible).
El electromagnetismo es la causa de una sola de las cuatro fuerzas fundamentales conocidas que conforman y dominan todo el universo, un universo que no sólo posee energía, sino que, gracias a esas fuerzas (otra de ellas es la gravitatoria, también descubierta por nuestro amigo Isaac), es capaz de generar variadas formas de materia, a partir de un concepto fundamental: el átomo.
Protones, electrones y neutrones: tanta fuerza, tanta fuerza
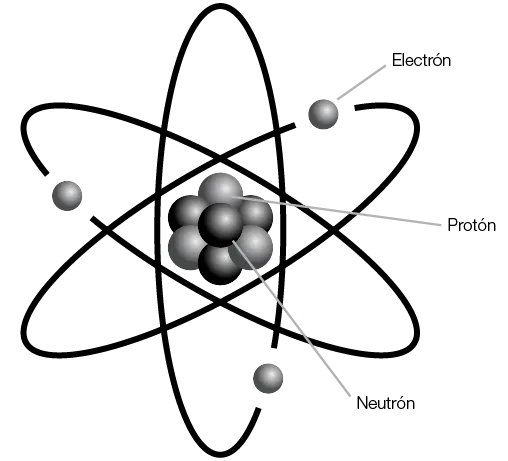
A decir verdad, no se necesita demasiado para armar un átomo; básicamente, alcanza con tres tipos de partículas: los protones (con carga positiva), idéntica cantidad de electrones (mucho más pequeños y de carga negativa), y un tanto de neutrones, de tamaño y masa similar a los protones, pero sin carga eléctrica. Los protones y los neutrones forman un conjunto bien unido llamado “núcleo”, alrededor del cual se desplazan los electrones siguiendo las extrañas leyes de la mecánica cuántica (imagen 2).
Lo que identifica a cada elemento es la cantidad de protones que posee (a fin de cuentas, lo importante es lo de adentro). Por ejemplo, si tiene 26, será un átomo de hierro. Y si tiene más o menos cantidad de protones, tendrá otra denominación; por ejemplo, si tiene 20 protones, será un átomo de calcio, o quizá se llamará nitrógeno si posee un núcleo con tan sólo 7 protones. Todos los elementos que aparecen en la tabla periódica difieren específicamente en eso, la cantidad de protones.
Imagen 2. Partículas constituyentes de un átomo.
Pero también pueden existir átomos del mismo elemento (con el mismo número de protones), en los cuales varía la cantidad de los electrones. Aquellos que pierden o ganan electrones resultan en un átomo con una carga neta, algo que se ha denominado “ión”. Cuando un elemento neutro gana un electrón “extra”, el resultado es un átomo con carga negativa, una especie llamada “anión”; mientras que, al perder electrones, resulta una especie con carga positiva llamada “catión”.
Además de contabilizar los protones y los electrones, hay que vigilar bien el otro tipo de partículas del núcleo: los neutrones.
Dentro de los elementos de un mismo tipo existen variedades que se deben, justamente, a la cantidad de neutrones que portan; como los átomos no son exactamente iguales, se los llama “isótopos” de un mismo elemento. Un átomo de hierro podrá tener 30 neutrones, y otro, 28; ambos serán átomos de hierro porque tienen 26 protones (eso es lo que los identifica como hierro), pero se tratará de dos isótopos del hierro.
Para identificar a los diferentes isótopos no se le cambia el nombre a cada uno, algo que resultaría complicado, sino que se lo hace con un número que resulta ser la suma de los protones y los neutrones. Los del ejemplo anterior serían hierro-56 (56Fe) y hierro-54 (54Fe). Cada casillero de la tabla periódica de los elementos representa un resumen promedio de los isótopos que se encuentran en la naturaleza.
Si se le asigna un casillero a cada isótopo, se construye otra tabla, mucho más amplia, denominada “tabla de isótopos” o “de núclidos”, en la que se presentan en cada fila los isótopos de los distintos elementos en orden ascendente. El resultado es una colección de más de 2000 cuadraditos, cada uno correspondiente a un isótopo de algún elemento. ¡Imaginen cuán difícil hubiera resultado si le hubiesen puesto un nombre diferente a cada isótopo! Originalmente, a los isótopos conocidos del hidrógeno (el elemento más pequeño y simple) se les asignó un nombre: el hidrógeno-1 se conoció como “protio”, el hidrógeno-2, como “deuterio”, y el hidrógeno-3 fue el “tritio”; incluso estos últimos suelen simbolizarse con los antiguos símbolos D y T, hecho que a veces genera confusión a incautos usuarios de la tabla periódica (en la que, por supuesto, no están detallados, pues los tres se encuentran en el cuadradito con la letra H que identifica al elemento hidrógeno).
Núcleos
Entonces, la clave para el comportamiento de los diferentes elementos y de sus distintos isótopos se encuentra en el núcleo atómico. Los protones y los neutrones que lo conforman (a menudo llamados “nucleones” para referirse indistintamente a ellos) poseen casi la misma masa, aunque la del neutrón es un poquito mayor.
El núcleo atómico es una de esas entidades que solemos asumir con normalidad a pesar de que se trata de una situación bastante irregular, al menos desde el punto de vista de las leyes del electromagnetismo; lo raro es que todos los protones se encuentran juntos y, de acuerdo con las leyes más básicas de la física, las cargas de un mismo signo tienden a repelerse. Eso significa que los protones no deberían estar unidos entre sí. Pero de todas formas lo están… ¿Qué es lo que sucede?
Hay que considerar un nuevo tipo de fuerza capaz de mantener unidas las partículas del núcleo a pesar de la repulsión entre las cargas positivas de los protones, fuerza que siempre ha existido y seguirá existiendo. Se trata de un tipo de fuerza llamada “interacción nuclear fuerte” que difiere bastante de las otras conocidas (la gravedad y la electromagnética, ya mencionadas) por ser de muy corto alcance, menor que el tamaño del núcleo (por eso, sólo se aplica en este tipo de situaciones subatómicas).
Más allá de la repulsión entre las cargas iguales, la cosa cambia cuando los protones están acompañados por neutrones, pues en ese caso la interacción fuerte se hace más fuerte aún, pero no ocurre lo mismo con la de repulsión, porque estamos agregando al conjunto partículas que no tienen carga. El resultado de ese aumento en la atracción entre las partículas es que se evita la separación de los protones, lo que hace posible la existencia del núcleo. Podríamos considerar a los neutrones como una especie de pegamento para núcleos; recuerden esto la próxima vez que digan que los neutrones no sirven para nada, cosa que ocurre en toda conversación de amigos en un bar.
El resultado de todo esto es que, en el caso de los elementos más livianos, es suficiente una cantidad de neutrones igual a la de protones para lograr un núcleo estable. Esto deja de cumplirse en los elementos más pesados, donde los núcleos estables necesitan una cantidad de neutrones mayor que la de protones. Incluso así, la situación resulta insostenible en núcleos que tienen más de 82 protones (número correspondiente al plomo), los cuales inevitablemente serán inestables, por lo que tarde o temprano sufrirán algún tipo de desintegración. La fuerza que mantiene unidos a los nucleones entre sí ya no resulta tan efectiva en esos casos y en algún momento sufrirá alguna transformación a una forma más estable.
Una consecuencia directa de lo visto hasta ahora es que todos y cada uno de los átomos de los diferentes elementos existentes en el universo corresponden a un isótopo determinado (y se los llama “núclidos”). Ese isótopo puede ser estable, lo que implica que seguirá teniendo el mismo núcleo para siempre, o puede ser inestable y sufrir algún tipo de desintegración...