
eBook - ePub
Disponible hasta el 19 Apr |Más información
Una faceta desconocida de Einstein
Este libro está disponible para leerlo hasta el 19º abril, 2026
- 103 páginas
- Spanish
- ePUB (apto para móviles)
- Disponible en iOS y Android
eBook - ePub
Disponible hasta el 19 Apr |Más información
Una faceta desconocida de Einstein
Descripción del libro
El propósito de la presente obra es divulgar aquellos trabajos científicos de Einstein menos conocidos en comparación con la popular teoría de la relatividad. Para tal efecto, el profesor Braun nos ofrece un recorrido por las vertientes poco exploradas que tienen relación con descubrimientos y teorías que han gozado de menor difusión.
Tools to learn more effectively

Saving Books

Keyword Search

Annotating Text

Listen to it instead
Información
Categoría
Ciencias físicasCategoría
FísicaXII. Las siguientes etapas de la historia
Al finalizar el primer Congreso Solvay, en 1911, termina la etapa inicial de la historia de la teoría cuántica, en la que gran parte de la comunidad científica ha reconocido que en la suposición de Planck hay “algo” real. Fueron los trabajos de Einstein ya mencionados donde por primera vez se aplicaron estas ideas. Los modelos en que se usaron estas ideas fueron esencialmente de osciladores armónicos. Las ideas cuánticas no se habían aplicado a otro tipo de sistemas, ni se sabía cómo hacerlo. Sin embargo, las aplicaciones hechas fueron suficientes para concluir que la física clásica era limitada. El problema entonces sería cómo desarrollar una teoría consistente.
En 1913 se inicia la segunda etapa del desarrollo de la física cuántica, al publicar Niels Bohr su notable trabajo Sobre la constitución de átomos y moléculas, en el cual aplicó las ideas cuánticas a la estructura del átomo de hidrógeno. Para apreciar esta contribución haremos un breve paréntesis.
En 1666 Newton inició el estudio de la luz por medios espectroscópicos al hacer incidir un haz luminoso sobre un prisma y descubrir que, debido a la refracción, se separaban las componentes de las que estaba formado el haz (figura 8). En particular, descubrió de esta manera que la luz blanca que nos llega del Sol está compuesta por todos los colores, formando un continuo. Esto significa que al fijarnos en los colores que salen del prisma, se pasa de un color a otro de manera continua, imperceptible. Esta descomposición nos es familiar, pues basta recordar el arco iris que forma no un prisma sino las gotas de agua de la lluvia.
Posteriormente se aplicó este método para estudiar la luz que emiten diversas sustancias. Esto se hizo calentándolas y haciendo incidir la luz que emiten sobre un espectroscopio. Éste es un aparato (figura 31) que tiene un prisma para analizar la luz. De esta forma se descubrió que la luz que emiten las sustancias no está formada, en general, por un continuo de colores, sino que solamente están presentes ciertos colores. Por ejemplo, en los gases sólo se observan rayas o líneas de ciertos colores. A este conjunto de colores se le llama el espectro de la sustancia. Así, en la figura 32 se muestran algunos espectros de gases como neón, mercurio, sodio. Cada una de estas líneas tiene un color bien preciso. Por ejemplo, la línea del sodio es amarilla. Empíricamente se pudieron encontrar las frecuencias de las líneas que aparecían en los espectros de muchas sustancias, en particular de elementos químicos. Es importante mencionar que los espectros son característicos de cada sustancia. Como se ve en la figura 32, distintas sustancias tienen espectros distintos. De hecho, el espectro ha servido para identificar sustancias, utilizando algo así como su huella digital. De este modo, estudiando espectroscopicamente la luz que llega de los planetas, las estrellas y demás cuerpos estelares se ha podido determinar de qué sustancias están compuestos.
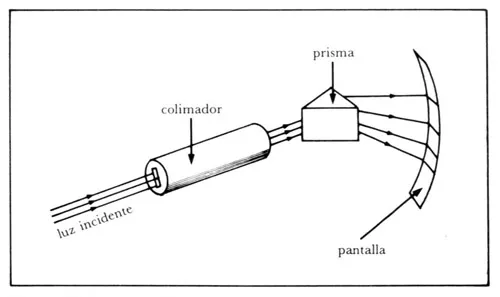
Figura 31. Esquema de un espectroscopio, que se usa para analizar las componentes de un haz de luz emitido por cualquier sustancia.

Figura 32. Espectros del neón, mercurio y sodio obtenidos con un espectroscopio. Cada línea corresponde a un color (frecuencia) bien determinado. La línea marcada del sodio tiene color amarillo.
Hacia fines del siglo pasado ya se habían estudiado con mucho detalle los espectros de muchas sustancias. Se pudo determinar también que eran las partículas que forman a los cuerpos las que emiten las líneas características del espectro. Se creyó que las diferencias entre los espectros y la complejidad de algunos de ellos (en algunos espectros hay miles de líneas) tenía algo que ver con la estructura de las partículas mismas. Se presentaba la cuestión de cuáles eran los procesos por medio de los cuales las partículas que componen un cuerpo reciben energía (por ejemplo, del calentamiento) y la emiten en forma de luz (o más bien, de ondas electromagnéticas) de frecuencias bien definidas. Al aplicar la física clásica no se había podido explicar la causa de que los espectros fueran discretos.
Por otro lado, hacia finales del siglo pasado se habían empezado a formular los primeros modelos de la estructura de los átomos. Sin entrar en detalles, solamente mencionaremos que de todas las propuestas la que resultó relevante fue la hecha por Ernest Rutherford. En 1911 presentó un trabajo que resultó clásico La dispersión de partículas α y β por materia y la estructura del átomo, en el que mostró una serie de resultados de sus experimentos en los que concluía que el átomo debería tener una estructura análoga al sistema planetario solar, esto es, formado por un núcleo de carga eléctrica positiva, de mucha masa, en su centro y a su alrededor un conjunto de electrones, de carga eléctrica negativa, girando alrededor del núcleo (figura 33). Posterior a su publicación, este modelo fue verificado en diversas situaciones con el resultado de que era satisfactorio.
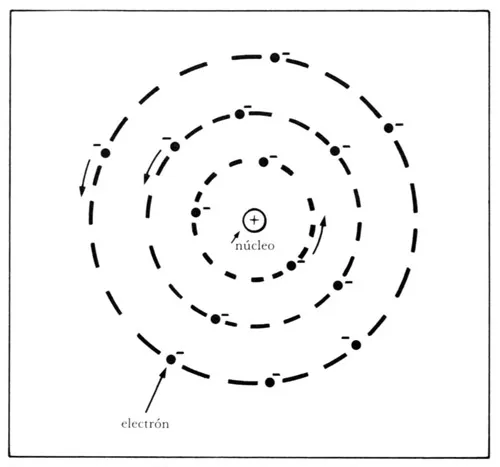
Figura 33. Modelo del átomo sugerido por Rutherford como consecuencia de sus experimentos.
En 1912, Niels Bohr se unió al grupo de Rutherford en Manchester, Inglaterra. Bohr llegó justo en un momento importante, cuando se investigaban las consecuencias del modelo atómico de Rutherford. Un problema al que de inmediato se dedicó Bohr fue el de la estabilidad del átomo propuesto. Como es natural, lo primero que hizo fue aplicar la física clásica a esta cuestión, dándose cuenta de que se llegaba a una inmensa contradicción; se dio cuenta de que la estabilidad del átomo, según el modelo de Rutherford, no podía reconciliarse con los fundamentos de la mecánica de Newton y el electromagnetismo de Maxwell.
La teoría electromagnética desarrollada por Maxwell requiere que si una partícula con carga eléctrica, como el electrón, se acelera, tiene que radiar energía electromagnética. En particular, un electrón girando alrededor de un núcleo se acelera, pues se trata de un movimiento que no es uniforme rectilíneo. Dado que las dimensiones de la órbita que recorre el electrón alrededor del núcleo dependen de la energía que tenga —y que al radiar energía la va perdiendo—, como consecuencia las dimensiones de la órbita tienen que disminuir. Según esto el electrón debería seguir una trayectoria en espiral (figura 34).
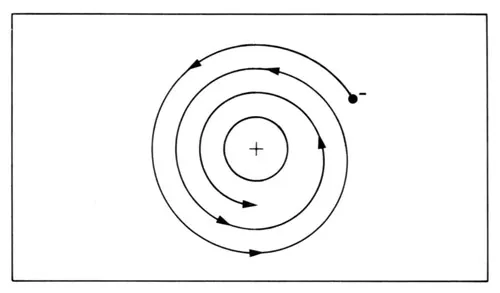
Figura 34. Según la mecánica clásica, un electrón en un átomo debe seguir una trayectoria espiral. Por tanto, este átomo no es estable, contrario a la experiencia.
Esto tiene dos consecuencias. La primera es que la radiación así emitida, según la teoría clásica, debe ser de frecuencias continuas; por lo tanto el espectro de tal átomo debería ser continuo. En segundo lugar, después de cierto tiempo, la órbita del electrón será tan pequeña que chocaría con el núcleo y, por tanto, desaparecería el átomo. Es decir, al aplicar la física clásica al modelo de Rutherford predice que ¡la materia no es estable! Como dijo Bohr en su trabajo:
El electrón se acercará al núcleo, describiendo órbitas de dimensiones menores y menores y girará con frecuencias mayores y mayores […]. El proceso continuará hasta que las dimensiones de la órbita sean del mismo orden de magnitud que las dimensiones del electrón o las del núcleo. Un cálculo sencillo muestra que la energía radiada durante el proceso considerado será enormemente grande comparada con la radiada durante los procesos moleculares ordinarios.
Es obvio que el comportamiento de tal sistema será muy distinto al de un sistema atómico que ocurre en la naturaleza. En primer lugar los átomos reales en su estado permanente parecen tener dimensiones y frecuencias absolutamente fijas. Además, si consideramos cualquier proceso molecular, los resultados siempre parecen ser que, después de que cierta cantidad de energía característica del sistema en cuestión es radiada, el sistema se acomodará otra vez en un estado de equilibrio estable, en el cual las distancias entre las partículas son del mismo orden de magnitud que tenían antes del proceso.
Sin embargo, la forma de considerar un problema de este tipo ha experimentado alteraciones esenciales en los últimos años debido al desarrollo de la [teoría cuántica de la] radiación electromagnética, y la afirmación directa de las nuevas suposiciones introducidas en esta teoría, encontrada por experimentos en muy diversos fenómenos tales como calores específicos, efecto fotoeléctrico. El resultado de la discusión de estas cuestiones parece ser el acuerdo general de que el electromagnetismo clásico es inadecuado para describir el comportamiento de sistemas de tamaños atómicos. Cualquiera que sea la alteración en las leyes de movimiento de los electrones, parece ser necesario introducir en las leyes en cuestión una cantidad extraña al electromagnetismo clásico, es decir, la constante de Planck. Introduciendo esta cantidad, la cuestión de la configuración estable de los electrones en los átomos cambia esencialmente.
Motivado por lo anterior, Bohr sugirió una aplicación directa de la hipótesis del fotón de Einstein como sigue:
a) Abandonar la teoría electromagnética clásica en la medida de suponer que, en órdenes de magnitudes atómicas, los electrones pueden girar en órbitas estables sin radiar continuamente energía en forma de ondas electromagnéticas, como lo requeriría la teoría clásica. Así, la energía de un electrón depende de las dimensiones de su órbita. Al pasar el electrón de una órbita estable a otra, y en vista de que estas órbitas tienen dimensiones distintas, entonces el electrón tendrá otra energía. De esta manera el electrón cambia de energía solamente al transferirse de una órbita a otra. Mientras permanezca en su órbita el electrón tendrá la misma energía. Dependiendo de si la órbita final tiene un tamaño mayor o menor, el electrón absorberá o emitirá energía, es decir, radiará ondas electromagnéticas. Aquí Bohr, de hecho, supuso la existencia de un conjunto discreto de órbitas estacionarias.
b) En seguida, Bohr usa el modelo de Einstein. La energía absorbida o emitida por un electrón al cambiar de órbita está asociada con la absorción o emisión de fotones individuales o cuantos de energía. La frecuencia de estos fotones multiplicada por la constante de Planck, o sea su energía, es igual a la diferencia de energía del electrón al pasar de una órbita a otra. Esto quiere decir que el cambio de energía que experimenta el electrón es justamente la energía del fotón absorbido o emitido. En particular, si un electrón pasa de una órbita grande a otra pequeña (figura 35) disminuye su energía, por lo que emite un fotón que tiene justamente esta energía, y por tanto una frecuencia bien determinada.
c) Para proceder en la aplicación de la cuantización, Bohr hizo lo siguiente. Se dio cuenta que la constante de Planck era una cantidad que tenía las mismas dimensiones que otra con la que se trabaja mucho en mecánica, a saber, el momento angular. Hizo la suposición de que el momento angular del electrón solamente puede tener valores iguales a múltiplos de la constante de Planck.
Bohr trabajó con el átomo más sencillo posible, el de hidrógeno, ya que solamente tiene un electrón. Con las suposiciones anteriores Bohr encontró los valores de las frecuencias que debería tener la radiación emitida por el electrón. Resultó que estos valores que obtuvo concordaban, en un buen grado de precisión, con los valores experimentales que ya se conocían desde hacía mucho tiempo. Además, encontró, en términos de la masa del electrón, de las cargas eléctricas del electrón y del núcleo y de la constante de Planck, una cantidad que se había obtenido empíricamente, en relación a los espectros de los átomos, que es la llamada constante de Rydberg. Asimismo, Bohr predijo la existencia de otras líneas del espectro que no caían en la región visible, sino en el ultravioleta extremo y en el infrarrojo extremo. Parte de estas predicciones fueron verificadas experimentalmente por T. Lyman en 1914, otra parte por F. Brackett en 1922 y otra parte más por A. H. Pfund en 1924.
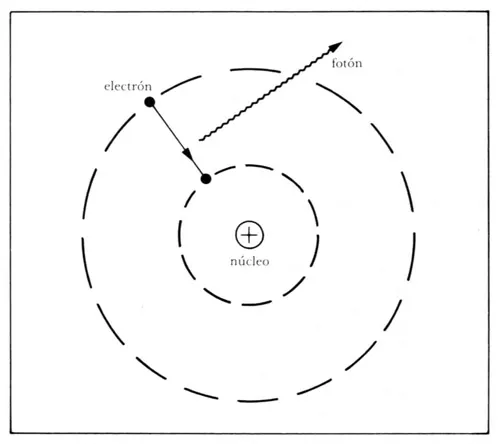
Figura 35. Según Bohr, un electrón al pasar de una órbita grande a una más pequeña emite un fotón.
El trabajo de Bohr fue recibido, en general, en forma favorable. Einstein se dio cuenta de la importancia de este trabajo. Se refirió a él como un “logro enorme” y como “uno de los más grandes descubrimientos”. En esa época Einstein trabajaba en Zurich, donde semanalmente se llevaba a cabo un coloquio de física. En uno de los coloquios se presentó la teoría de Bohr. Al final de la discusión el notable físico Max von Laue explotó: “Son tonterías. La teoría de Maxwell es válida en todas las circunstancias.” A lo que Einstein contestó: “Muy notable. Debe haber algo atrás de esto. No creo que la derivación del valor de la constante de Rydberg sea puramente fortuita.”
En Inglaterra el trabajo de Bohr causó sensación. Así el físico James Jeans declaró “los resultados obtenidos son muy notables para descartarlos como puramente accidentales”. The Times publicó una nota con el encabezado “La ingeniosa explicación del Dr. Bohr del espectro del hidrógeno”.
A pesar del gran éxito que obtuvo Bohr con el átomo de hidrógeno, al intentar extender la teoría a otros átomos aparecieron dificultades importantes. En los años siguientes fueron Planck (ya más convencido de que la teoría cuántica tenía realidad física) y Arnold Sommerfeld quienes estuvieron muy activos en el desarrollo de la teoría.
Arnold Sommerfeld generalizó la aplicación de las condiciones de cuantización para casos más complicados. En particular, usó la condición de la cuantización del momento angular no con la mecánica de Newton como lo había hecho Bohr sino con la mecánica relativista que había desarrollado Einstein. En 1916 encontró que cada una de las líneas que había obtenido Bohr se dividía en varias líneas muy cercanas entre sí (figura 36). Este efecto, llamado de estructura fina, ya lo había descubierto A. A. Michelson en 1891 al medir con muchísima precisión las líneas espectrales del hidrógeno y debe añadirse que es extremadamente pequeño y que durante mucho tiempo no fue tomado en cuenta por los científicos. Posteriormente, F. Paschen lo midió con muy alta precisión en el espectro del helio ionizado[1] obteniendo una extraordinaria concordancia cuantitativa con la predicción de Sommerfeld.
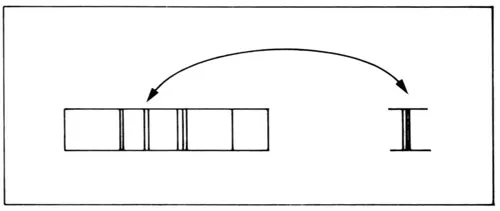
Figura 36. Al analizar muy detenidamente cada línea del espectro, resulta que está formada por varias líneas muy juntas entre sí.
Con base en la generalización de Sommerfeld, se desarrolló todo un cuerpo de teoría sobre la estructura atómica y los espectros correspondientes.
Por otro lado, en 1916, después de haber terminado de formular la teoría de la relatividad general, Einstein volvió a tomar el problema de la radiación electromagnética y derivó de una manera más general la distribución que Planck había obtenido en 1900. Para ello analizó con detenimiento el mecanismo de las transiciones que ocurren al pasar el electrón de una órbita a otra, o sea de un estado a otro. Einstein hizo la suposición de que estas transiciones están gobernadas por una probabilidad de ocurrencia. Para encontrar la distribución consideró primero la probabilidad de la absorción de un fotón al pasar un electrón de un estado de baja energía a otro de mayor energía. Naturalmente, el átomo absorbe esta energía de la radiación presente en la que se encuentra. Además, consideró la probabilidad de que un electrón pase de un estado de energía alta a otro de energía más baja. De esta manera emite un fotón. Sin embargo, para poder llegar a la distribución de Planck, Einstein descubrió que la emisión puede ocurrir por medio de dos mecanismos distintos: uno es la emisión espontánea, proceso que se da al estar el electrón en un estado de alta energía y, sin que medie factor externo o conocido alguno, de pronto emite un fotón y el electrón pasa aun estado de energía más baja. Este proceso de emisión ocurre aun cuando el átomo no se encuentre en presencia de radiación. Este mecanismo es el que se esperaría que ocurriera, ya que, en general, un sistema tiende a alcanzar, espontáneamente, su estado de energía más bajo. Sin embargo, Einstein descubrió que es necesario que también ocurra otro proceso de emisión, que él denominó emisión inducida o estimulada. Esto significa que, en presencia de radiación, este campo externo estimula al átomo a que el electrón pase de un estado de alta energía a otro de baja energía. En la teoría elec...
Índice
- Portada
- Introducción
- I. Algo sobre la termodinámica. ¿Qué es el calor específico?
- II. Primeras mediciones del calor específico
- III. ¿Qué nos dice la teoría cinética?
- IV. Otras experiencias y resultados al inventarse los primeros refrigeradores
- V. El trabajo de Nernst.La tercera ley de la termodinámica
- VI. Resumen de la situación a principios del siglo XX
- VII. Algunas consideraciones sobre la naturaleza de la luz
- VIII. Otra vertiente. Planck y la teoría cuántica
- IX. Einstein y el efecto fotoeléctrico
- X. Einstein da la luz al enigma de los calores específicos
- XI. Repercusiones en el desarrollo conceptual de la teoría cuántica
- XII. Las siguientes etapas de la historia
- Fotografías
- Índice
Preguntas frecuentes
Sí, puedes cancelar tu suscripción en cualquier momento desde la pestaña Suscripción en los ajustes de tu cuenta en el sitio web de Perlego. La suscripción seguirá activa hasta que finalice el periodo de facturación actual. Descubre cómo cancelar tu suscripción
No, los libros no se pueden descargar como archivos externos, como los PDF, para usarlos fuera de Perlego. Sin embargo, puedes descargarlos en la aplicación de Perlego para leerlos sin conexión en el móvil o en una tableta. Descubre cómo descargar libros para leer sin conexión
Perlego ofrece dos planes: Essential y Complete
- El plan Essential es ideal para los estudiantes y los profesionales a los que les gusta explorar una amplia gama de temas. Accede a la biblioteca Essential, con más de 800 000 títulos de confianza y superventas sobre negocios, crecimiento personal y humanidades. Incluye un tiempo de lectura ilimitado y la voz estándar de «Lectura en voz alta».
- Complete: perfecto para los estudiantes avanzados y los investigadores que necesitan un acceso completo sin ningún tipo de restricciones. Accede a más de 1,4 millones de libros sobre cientos de temas, incluidos títulos académicos y especializados. El plan Complete también incluye funciones avanzadas como la lectura en voz alta prémium y el asistente de investigación.
Somos un servicio de suscripción de libros de texto en línea que te permite acceder a toda una biblioteca en línea por menos de lo que cuesta un libro al mes. Con más de un millón de libros sobre más de 990 categorías, ¡tenemos todo lo que necesitas! Descubre nuestra misión
Busca el símbolo de lectura en voz alta en tu próximo libro para ver si puedes escucharlo. La herramienta de lectura en voz alta lee el texto en voz alta por ti, resaltando el texto a medida que se lee. Puedes pausarla, acelerarla y ralentizarla. Obtén más información sobre la lectura en voz alta
¡Sí! Puedes usar la aplicación de Perlego en dispositivos iOS y Android para leer cuando y donde quieras, incluso sin conexión. Es ideal para cuando vas de un lado a otro o quieres acceder al contenido sobre la marcha.
Ten en cuenta que no será compatible con los dispositivos que se ejecuten en iOS 13 y Android 7 o en versiones anteriores. Obtén más información sobre cómo usar la aplicación
Ten en cuenta que no será compatible con los dispositivos que se ejecuten en iOS 13 y Android 7 o en versiones anteriores. Obtén más información sobre cómo usar la aplicación
Sí, puedes acceder a Una faceta desconocida de Einstein de Eliezer Braun en formato PDF o ePUB, así como a otros libros populares de Ciencias físicas y Física. Tenemos más de un millón de libros disponibles en nuestro catálogo para que explores.