16
MOLÉCULAS Y ESTRATEGIAS DE LA VIDA
La vida abre algunas perspectivas sobre la materia bastante distintas de las que ya hemos considerado, ya que presenta un dinamismo característico, muy complejo, y sigue unas estrategias diferentes de las de la materia inanimada. La definición misma de vida intenta superar el marco de la vida que conocemos, para explorar otros tipos de vida, y se refiere a una serie de funciones más que a una serie de materiales. Esas cuestiones tienen hoy una relevancia especial, ya que estamos pasando de la biología molecular, que estudia las moléculas que forman las células, a la biología sintética, que intenta fabricar células vivas a partir de las biomoléculas conocidas, o incluso utilizando otros tipos de moléculas.
DEFINICIÓN DE VIDA
Definir la vida es difícil, pero no lo podemos rehuir, si queremos referirnos no tan solo a a la vida que sabríamos reconocer intuitivamente, sino también a otros tipos de vida, tema de especial interés por la importancia actual de los estudios sobre el origen de la vida, la vida sintética o la vida extraterrestre. En esas situaciones, las intuiciones que podamos tener respecto a la vida sirven de poco; es posible que ante formas de vida muy diferentes fuéramos incapaces de reconocerlas. Así, para poder discernir si un sistema puede ser considerado un organismo vivo, debemos especificar una serie de criterios genéricos.
Podemos caracterizar la vida por cinco rasgos generales: los procesos de metabolismo —conjunto de reacciones químicas que procesan materia y energía—; la reproducción, es decir, la capacidad de replicar —con variantes— organismos similares a los originales; la evolución, o capacidad de generar nuevas variedades de organismos adaptados a medios diversos; la autopoiesis, o conjunto de mecanismos de control que estabilizan sus características básicas frente a un cierto rango de variación de las condiciones del entorno; y una cierta lejanía respecto al equilibrio termodinámico. Esas características, sin embargo, pueden resultar insuficientes: por ejemplo, ante un sistema concreto, no sabremos inmediatamente si es capaz de reproducirse o no; nos podría interesar si un sistema puede ser el resto fósil de un organismo vivo anterior o si es una formación puramente inorgánica. Esas características tampoco son útiles para distinguir entre la vida y la muerte de organismos pluricelulares, y menos aún para definir clínicamente la muerte de una persona, de forma que aún sean aprovechables algunos de sus órganos para trasplantes. La definición de vida en términos genéricos es más fácil que su definición precisa y con responsabilidades operativas.
La definición aproximada del párrafo anterior nos bastará para reflexionar sobre los elementos materiales de la vida. Aunque no podemos excluir que haya vida basada en materiales diferentes, debe tratarse de materiales que no sean incompatibles con las características de la vida.
DE LA QUÍMICA A LA VIDA
¿Hasta qué punto las propiedades de la materia viva pueden ser deducidas de la física y la química? En la evolución biológica, el azar y la historia juegan un papel decisivo, lo que establece algunas diferencias sutiles entre el marco de pensamiento de la físico-química y el de la biología. En efecto, la física y la química tratan situaciones de validez universal; en cambio, las características de la vida dependen de una combinación de historia particular y de restricciones físico-químicas generales.
Un ejemplo ilustrativo es que en los organismos los azúcares están formados por cadenas dextrógiras y las proteínas por aminoácidos levógiros —dextrógiro y levógiro se refieren a simetrías especulares de las estructuras moleculares. Ahora bien, en los procesos abióticos de formación de aminoácidos o de azúcares se producen tantas cadenas de un tipo como del otro. La utilización casi exclusiva de una de ellas en los organismos es probablemente el resultado de un azar inicial, amplificado por los procesos de reproducción, es decir, resulta incomprensible si no se tiene en cuenta el papel de la historia. La física y la química difícilmente podrían predecir qué tipos de cadenas serían utilizadas para la vida en otros planetas.
Otro ejemplo es el número de aminoácidos diferentes que intervienen en las proteínas: veinte. Sin embargo, se puede fabricar muchos más tipos de aminoácidos. Se plantea pues la pregunta de por qué en la vida intervienen veinte y no quince, doce o veinticuatro aminoácidos o por qué intervienen esos veinte aminoácidos concretos en lugar de otros veinte. Si halláramos vida extraterrestre, probablemente tendría un número diferente de aminoácidos. Es lógico que en la vida en cualquier planeta intervengan los aminoácidos más sencillos, pero no los complicados. Vemos que una consideración puramente físico-química no es suficiente para entender la vida: también es necesario tener presente su dimensión histórica.
Esto nos advierte con qué matices hay que entender que la vida pueda reducirse a física y química. Eso es verdad si queremos decir que los materiales y procesos que nos descubre la biología pueden ser explicados a posteriori mediante las leyes de la física y la química, pero no, en cambio, si queremos decir que a partir de esas ciencias podemos deducir la biología. De hecho, nadie ha sido capaz de deducir la química a partir de la física —ni de deducir tan solo la existencia del benceno, los fullerenos o los aminoácidos, a partir de las leyes de la física cuántica—; lo que sí se ha hecho es, una vez la química ha descubierto y sistematizado una serie de sustancias, interpretar estas a partir de las leyes cuánticas, al menos aproximadamente, ya que los cálculos exactos no son factibles.
LAS PROPIEDADES DEL AGUA
Varias de las estrategias generales de la vida están condicionadas por el agua, que parece imprescindible para la vida que conocemos, pero que tal vez no lo sea para otros tipos de vida. En todo caso, debemos abordar primero algunas de sus propiedades para poder comprender otras características de la vida condicionadas por ella. La existencia de muchos otros líquidos hace parecer lógica la posibilidad de que algunos de ellos pudieran ser la base de otros tipos de vida, pero ello no es tan fácil como podría parecer, ya que el agua tiene algunas propiedades sorprendentes.
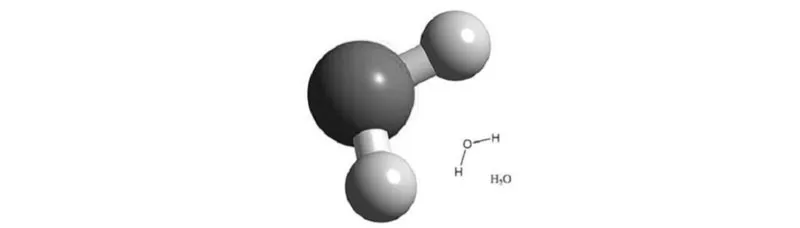
La molécula de agua, H2O, compuesta por un átomo de oxígeno y dos de hidrógeno, tiene una estructura angular, con el oxígeno en el vértice y los hidrógenos en los extremos de los lados, con un ángulo de unos ciento cuatro grados y medio. Cada átomo de hidrógeno comparte con el de oxígeno un par de electrones, pero estos pasan más tiempo cerca del oxígeno que del hidrógeno. Como consecuencia, la molécula de agua es polar, es decir, aunque en su conjunto es eléctricamente neutra, está cargada positivamente en un extremo y negativamente en el otro. Esta característica tiene gran importancia para la vida, como veremos.
Fig. 16. 1. El carácter polar de la molécula del agua (oxígeno cargado negativamente, hidrógenos cargados positivamente) tiene consecuencias profundas en muchos aspectos, desde el plegamiento de las proteínas a la formación de membranas.
Entre moléculas de agua vecinas se establecen enlaces de puente de hidrógeno: el hidrógeno positivo de una molécula se siente atraído electrostáticamente por el oxígeno negativo de otra molécula próxima. Ello tiene consecuencias importantes en las propiedades del agua. Esos enlaces hacen que las temperaturas de fusión y de ebullición sean mucho más elevadas de lo que serían sin ellos. Por ejemplo, el ácido sulfhídrico SH2, formado por un átomo de azufre y dos de hidrógeno —muy parecida pues a la del agua, ya que tiene un azufre en lugar de un oxígeno— se congela a ochenta grados bajo cero y hierve a sesenta grados bajo cero. Si no fuera por su carácter polar y sus puentes de hidrógeno, el agua se congelaría y herviría a esas temperaturas, y no a cero grados y cien grados, respectivamente. Por otro lado, los calores específicos y latentes del agua son elevados (unas cuatro veces mayores que los del SH2), a causa de los puentes de hidrógeno. El agua tiene un volumen mínimo a cuatro grados, y se dilata cuando se enfría por debajo de esta temperatura, y el hielo es menos denso que el agua, a causa de las redes de moléculas de agua unidas por puentes de hidrógeno. Eso hace que los lagos y ríos se hielen por encima y queden protegidos, lo que permite que los organismos acuáticos puedan sobrevivir a los grandes fríos.
El carácter polar hace que el agua sea buen disolvente para sustancias polares e iónicas (sal común) y mal disolvente para sustancias apolares (aceites o benceno). Ello implica que haya moléculas hidrofílicas (amigas del agua), moléculas hidrofóbicas (enemigas del agua), y moléculas con partes hidrofóbicas y partes hidrofílicas. Esto tiene una gran importancia para el plegamiento de proteínas y para la formación de membranas biológicas. Por ello, en ausencia del agua, la vida se debería basar en materiales diferentes a los actuales.
ESTRATEGIAS GENERALES DE LA VIDA
Algunas estrategias generales de la vida son las siguientes:
— El uso de macromoléculas, ya que con muchas moléculas pequeñas las células reventarían por presión osmótica; por ejemplo, para guardar glucosa, la célula debe polimerizarla en forma de glucógeno o almidón, para no reventar; además, moléculas pequeñas no podrían realizar las complicadas operaciones que realizan moléculas grandes.
— El uso de supramoléculas, es decir, de asociaciones ocasionales de macromo...