La Chimica studia le trasformazioni permanenti della materia. Le formule chimiche descrivono la composizione, la struttura e le caratteristiche di ogni componente del mondo che ci circonda, organico ed inorganico. Le proprietà della materia sono definite dalla struttura delle particelle che la compongono (molecole). Col termine molecola si intende la più piccola particella che possiede le proprietà chimico-fisiche della sostanza da cui proviene. Le molecole sono formate da uno o più atomi uguali o diversi. Per esempio, l’anidride carbonica (CO2) è costituita da molecole formate dall’unione di un atomo dell’elemento carbonio e due atomi dell’elemento ossigeno, mentre la sostanza ossigeno (O2) è una molecola composta da due atomi dello stesso elemento. In ogni trasformazione chimica si ha sempre formazione di nuove strutture molecolari e quindi di nuove sostanze. L’atomo è la parte più piccola di un elemento chimico che conserva le caratteristiche chimiche dell’elemento in massa.
MASSA ATOMICA
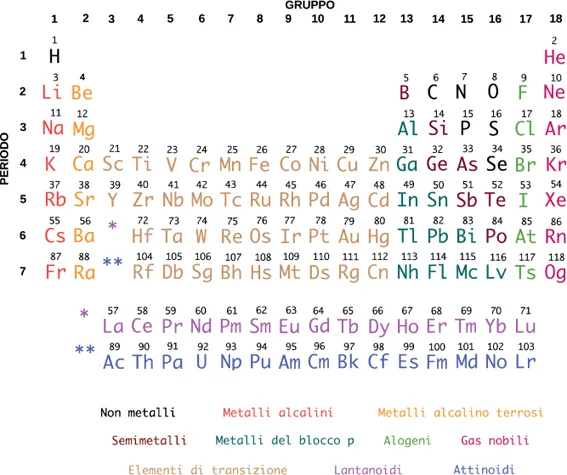
Gli atomi sono costituiti da un nucleo positivo intorno a cui ruotano gli elettroni su orbite caratterizzate da un definito livello energetico. Ogni elettrone ha massa pari a 9,109 × 10-28 g, molto piccola e trascurabile nei calcoli ponderali delle reazioni chimiche. La carica dell’elettrone è pari a 1,602 × 10-19 C. Il nucleo atomico è formato da protoni e neutroni. Per convenzione, come spiegato più avanti, ogni protone ha massa uguale a 1 e viene indicato col simbolo P o H+ perché il protone è anche il nucleo dell’atomo di idrogeno, costituito da un protone ed un elettrone; la sua carica è uguale a quella dell’elettrone, ma di segno contrario. Ogni neutrone ha massa = 1 e carica = 0. In condizioni di equilibrio ogni atomo è elettricamente neutro perché il numero degli elettroni è uguale a quello dei protoni. Con il termine ione positivo si intende un atomo od una molecola privati di uno o più elettroni, lo ione negativo è un atomo od una molecola che hanno aggiunto alla loro struttura neutra uno o più elettroni. Gli elementi si differenziano fra di loro per il diverso numero di protoni e neutroni e per il diverso arrangiamento delle orbite elettroniche. Il numero di protoni viene definito come numero atomico e determina la posizione dell’elemento nella Tavola Periodica degli elementi.
Esistono però atomi con lo stesso numero di protoni, ma con un differente numero di neutroni; questi atomi si chiamano isotopi e occupano la stessa casella nel sistema periodico. Il peso atomico dell’elemento che comprende due o più isotopi è una media, pesata rispetto alla loro abbondanza, di quello dei singoli isotopi. Essi hanno proprietà chimiche molto simili ma diverso comportamento nelle reazioni nucleari. Nella pagina precedente abbiamo riportato una versione semplificata della Tavola Periodica con l’indicazione del solo numero atomico.
Tutti gli atomi, con l’eccezione dei gas nobili (ultima colonna a destra), possono attuare fra di loro legami chimici con formazione di molecole. Col termine legame chimico si intende un legame che si mantiene stabile durante la maggior parte delle trasformazioni fisiche della materia, in quanto si verificano senza variazioni delle strutture molecolari. Ad esempio, quando l’acqua passa dallo stato liquido a quello di vapore ogni molecola [H2O] mantiene i suoi legami interni. I legami chimici si formano per interazione degli elettroni più esterni ed hanno una energia di legame (energia necessaria per rompere il legame) compresa fra 150 e 1.000 kJ/mole. Il legame covalente omopolare (o puro) è generato dalla sovrapposizione delle orbite di due elettroni appartenenti a due atomi uguali, come nel caso di due atomi di ossigeno che formano un sistema [O O] dove gli elettroni sono egualmente distribuiti tra i due atomi. Se però i due atomi hanno differente tendenza a trattenere gli elettroni (affinità) accade che l’atomo con maggior tendenza a trattenere l’elettrone si carica negativamente, mentre l’altro atomo del sistema si carica positivamente. In questo caso si dice che il legame è covalente polarizzato. Il legame covalente viene rappresentato graficamente da una lineetta (-) o da due punti (:) che rappresentano gli elettroni impegnati nel legame.
Il legame ionico si verifica se la differenza di affinità tra due atomi è molto forte. In questo caso l’atomo con minore affinità cede l’elettrone a quello con affinità maggiore. Si ha così la formazione di due ioni di carica opposta che si attraggono con forze coulombiane e generalmente si trovano nei nodi reticolari dei solidi cristallini, come nel caso del cloruro di sodio (NaCl)allo stato solido. Il legame covalente è caratteristico di tutte le molecole organiche mentre il legame ionico determina l’esistenza di gran parte dei composti inorganici.
Una delle più importanti e utili caratteristiche per lo studio e la classificazione degli elementi è la massa atomica, detta non correttamente peso atomico. La massa atomica degli elementi viene determinata con metodi fisici o chimici. L’unità di misura della massa atomica assunta per convenzione è data da un dodicesimo del peso dell’isotopo carbonio 12 (12C).
MASSA MOLECOLARE
La massa molecolare, detta anche peso molecolare, viene ottenuta sommando i pesi dei singoli atomi che compongono la molecola.
Sono noti e descritti circa 8 milioni di composti che derivano dalla combinazione di 118 elementi, presenti in natura o sintetizzati in laboratorio. Circa 6,5 milioni di composti contengono carbonio e costituiscono i cosiddetti composti organici. I rimanenti elementi danno luogo alla formazione di circa 1,5 milioni di composti che sono alla base del mondo inorganico. Il numero dei composti è in costante aumento a causa del procedere delle attività di ricerca. Per ogni sostanza sottoposta ad indagine la letteratura scientifica riporta le proprietà fisiche e chimiche e le reazioni chimiche più importanti. Ogni composto è identificato dalla formula bruta e dalla formula di struttura. La formula molecolare o bruta è costituita da una sequenza dei diversi atomi che costituiscono la sostanza; ogni atomo è seguito da un numero posto in basso (pedice) che dice quanti sono gli atomi di quel tipo che fanno parte della molecola. Dalla formula molecolare deriva la formula di struttura che mo...