
- 371 pages
- English
- ePUB (mobile friendly)
- Available on iOS & Android
About this book
Dieses Buch bespricht in klarer und verständlicher Sprache alle für die Bachelorprüfung in Physikalischer Chemie relevanten Themengebiete: Thermodynamik, Elektrochemie, Kinetik, Aufbau der Materie, quantenchemische Grundlagen, Spektroskopie, statistische Thermodynamik, sowie die notwendigen mathematischen Grundlagen. Darüber hinaus befindet sich am Ende eines jeden Kapitels ein inspirierendes, fiktives Prüfungsgespräch, das mit Studenten erarbeitet wurde und Raum zu eigenen Überlegungen lässt.
In drei Schritten führt Sie dieses Buch zum Erfolg. Es begleitet Sie schon während des Studiums bei der Aufarbeitung unverdauter Vorlesungsinhalte und verbindet dabei die isoliert, oft als zweckfrei erscheinende, Faktenfülle im Fach Physikalische Chemie. Nach Abschluss eines Hauptthemas stehen Ihnen in jedem Teil Fragen zur eigenständigen Denkarbeit bereit. Abschließend finden Sie zu jedem Kapitel auch fiktive Prüfungsgespräche, anhand derer Sie sich für den Realfall rüsten können.
Frequently asked questions
- Essential is ideal for learners and professionals who enjoy exploring a wide range of subjects. Access the Essential Library with 800,000+ trusted titles and best-sellers across business, personal growth, and the humanities. Includes unlimited reading time and Standard Read Aloud voice.
- Complete: Perfect for advanced learners and researchers needing full, unrestricted access. Unlock 1.4M+ books across hundreds of subjects, including academic and specialized titles. The Complete Plan also includes advanced features like Premium Read Aloud and Research Assistant.
Please note we cannot support devices running on iOS 13 and Android 7 or earlier. Learn more about using the app.
Information
1 Phänomenologische Thermodynamik
1.1 Die grundlegenden Größen und Konzepte
1.1.1 Reduktion des Systems aufwenige ausgewählte Zustandsgrößen
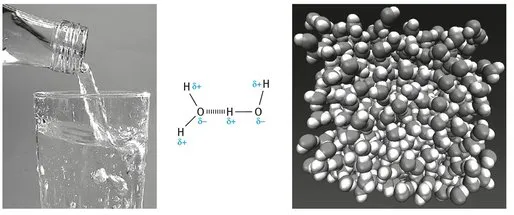
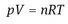
1.1.2 Wärme und Temperatur
- – die Temperatur T
- – die Wärmemenge Q
Table of contents
- Weitere empfehlenswerte Titel
- Titel
- Autoren
- Impressum
- Vorwort
- Hinweise zur Benutzung
- Über die Autoren
- Inhaltsverzeichnis
- 1 Phänomenologische Thermodynamik
- 2 Aufbau der Materie
- 3 Statistische Thermodynamik
- 4 Kinetik und Elektrochemie
- Anhang Mathematischer Leitfaden
- Danksagung
- Sachwortregister