![]()
1 Einleitung
Akkumulatoren, nachfolgend Akkus genannt, sind aus unserem täglichen Leben nicht mehr wegzudenken. Sie sind allgegenwärtige Begleiter und befinden sich z. B. in unserem Smartphone, dem MP3-Player, diversen Haushaltswerkzeugen, Spielsachen und nicht zuletzt im Auto. Wir nutzen diese Geräte zwar, machen uns über sie aber kaum Gedanken. Sie müssen nur funktionieren. Wenn sich der Akku geleert hat, wird einfach das Ladegerät angesteckt und nach einigen Stunden steht einem weiteren Betrieb nichts im Weg. Von den Akkus erwarten wir, dass sie so lange funktionieren, bis wir z. B. unser Smartphone gegen ein neues tauschen.
Der Akku kann auf eine über 200-jährige Geschichte zurückblicken. 1802 baute der deutsche Physiker Johann Wilhelm Ritter den ersten Akku, die Rittersche Ladungssäule. Seit damals ist die Entwicklung nicht stehen geblieben und hat zahlreiche Akkutypen hervorgebracht. Vor allem der Bleiakku, aber auch die Nickel-Kadmium- und Nickel-Metallhydrid-Zellen sowie Lithiumakkus sind weithin bekannt. Für sie und alle anderen Akkutypen gilt, dass ihre Lebensdauer nicht unendlich ist. Je nach Typ beschränkt sie sich auf wenige hundert oder vielleicht 1.000 Ladezyklen – unter optimalen Voraussetzungen. Wird mit dem Akku allzu sorglos umgegangen, segnet er schon deutlich früher das Zeitliche. Das ist besonders bei Geräten äußerst ärgerlich, in die der Akku fest eingebaut und nur gegen viel Geld in einer autorisierten Werkstatt getauscht werden kann. Damit reduziert sich die Lebensdauer mancher hochpreisigen Markensmartphones auf das Durchhaltevermögen des Akkus.
Allein das setzt voraus, genau über Akkus, deren Technologien und ihre korrekte Pflege Bescheid zu wissen. Das hilft uns nicht nur, Akkus länger am Leben zu erhalten, sondern auch, uns länger an den Geräten zu erfreuen, die wir mit ihnen betreiben.
![]()
2 Basiswissen
Akkus werden umgangssprachlich gern als wiederaufladbare Batterien bezeichnet. Aber klassische Batterien sind, im Gegensatz zu Akkus, nicht wiederaufladbar. Sie werden auch als Primärzelle (engl. primary battery) bezeichnet. Der Akku wird auch Sekundärelement (engl. secondary battery) genannt.
Werden sie geladen, wird die ihnen zugeführte elektrische in chemische Energie umgewandelt. Der Begriff »Akku« wird von uns umgangssprachlich recht locker verwendet, da wir keinen Unterschied machen, ob ein Akku nur aus einer oder aus mehreren Zellen besteht. Typische Einzellerakkus sind solche, die wir z. B. in unseren Fernsteuerungen verwenden. Typische Größen dafür sind Mignon(AA)- oder Mikro(AAA)-Akkus. Zu den Eigenschaften eines Akkus gehört auch, dass seine Zellenspannung eigentlich recht gering ist – zu gering für viele Anwendungen, für die wir Akkus einsetzen. Deshalb sind in vielen Akkugehäusen mehrere Zellen in Serie geschaltet, um die geforderten Betriebsspannungen zu erhalten.
Auch wenn vielfach nur Nickel-Kadmium(NiCd)-, Nickel-Metallhydrid(NiMH)-, Lithium-Polymer(LiPo)- und Bleiakkus geläufig sind, gibt es wesentlich mehr Akkutypen. Die Entwicklung zielt vor allem darauf ab, die in Akkus speicherbare Energiedichte zu verbessern. Hier wurden und werden größte Anstrengungen unternommen. Dabei geht es nicht nur darum, die Laufzeiten typischer Consumer-Geräte zwischen den Ladezyklen zu verbessern. Im Fokus steht vor allem die Autoindustrie und deren Bestreben, für die Allgemeinheit bezahlbare Elektroautos mit akzeptabler Reichweite auf den Markt zu bringen. Noch ist dieses Ziel nicht erreicht. Bis es so weit ist, profitieren wir aber bereits davon. So bilden die erst ab den frühen 1990er-Jahren auf den Markt gebrachten Lithiumakkus die Grundlage für unsere Smartphones und Tablet-PCs. Mit älteren Akkutechnologien wären diese nicht annähernd in dem uns gewohnten Umfang nutzbar.
Akkus haben, vom Auto bis zum Smartphone, längst alle nur erdenklichen Einsatzgebiete erobert. Aber nur zum Teil gibt es für die verschiedenen Einsatzgebiete spezielle Entwicklungen. Für verschiedene Anwendungen kommen zwar eigens dafür getrimmte Akkus zum Einsatz, ihnen gemeinsam ist aber, dass die heutige Typenvielfalt auf wenigen Grundkonzepten basiert. Die grundlegenden Eigenschaften vieler Akkus sind dieselben. Der Lithium-Polymer-Akku z. B. wird dank seiner hohen Energiedichte gleichermaßen im RC-Modellbau als auch in Smartphones und Tablet-PCs verwendet.
Da es nur wenige Akkugrundtypen gibt, ist es letztlich aber auch leicht, die Grundzüge der Akkutechnologie besser zu verstehen.
2.1 Elektrochemische Spannungsreihe
Jeder Akku besteht aus zwei Elektroden unterschiedlichen Materials, die sich in einem flüssigen oder gelartigen Elektrolyten befinden. Welche Metalle bei den Elektroden zum Einsatz kommen, entscheidet bei Akkus und Batterien darüber, welche Spannung sie maximal liefern können.
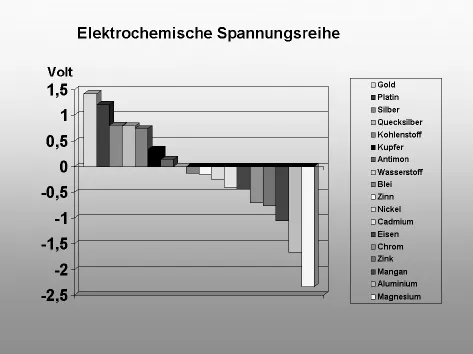
Die elektrochemische Spannungsreihe beruht auf dem Umstand, dass Metalle mehr oder weniger edel sind und sich das unedlere zersetzt. Als Beispiel dafür ist z. B. die Elektroinstallation zu nennen, bei der direkte Verbindungen zwischen Kupfer und Aluminium zwingend zu vermeiden sind. Würde bei einer solchen Verbindungsstelle Feuchtigkeit eindringen, würde zwischen beiden Metallen ein Potenzialunterschied entstehen. Die elektrochemische Spannungsreihe gibt Auskunft darüber, wie hoch dieser wäre. In ihr sind die Metalle nach ihrem elektrochemischen Potenzial geordnet. Dabei wird ihr Ladungsunterschied gegenüber dem Bezugsstoff Wasserstoff angegeben, der den Wert Null hat. Je positiver ein Metall gegenüber Wasserstoff ist, umso edler und auch beständiger ist es. Im Gegensatz ist es umso unedler, je negativer es ist. Der Potenzialunterschied zwischen den einzelnen Metallen und Wasserstoff wird mit der Spannung in Volt angegeben. Daraus ist auch ersichtlich, wie hoch die Spannungsdifferenz zwischen zwei Metallen ist.
Im zuvor genannten Beispiel mit Kupfer und Aluminium herrscht eine Spannungsdifferenz von 2,01 V. Das unedlere Aluminium würde sich mit der Zeit zersetzen. Auf derselben Basis funktionieren letztlich auch Batterien. Sie sind leer, wenn das unedlere Metall »aufgebraucht« ist.
Elektrochemische Spannungsreihe
| Gold | +1,42 V |
| Platin | +1,20 V |
| Silber | +0,80 V |
| Quecksilber | +0,79 V |
| Kohlenstoff | +0,74 V |
| Kupfer | +0,34 V |
| Antimon | +0,14 V |
| Wasserstoff | +/− 0,0 V |
| Blei | −0,12 V |
| Zinn | −0,14 V |
| Nickel | −0,25 V |
| Kadmium | −0,40 V |
| Eisen | −0,44 V |
| Chrom | −0,71 V |
| Zink | −0,76 V |
| Mangan | −1,05 V |
| Aluminium | −1,67 V |
| Magnesium | −2,34 V |
2.2 Anode und Kathode
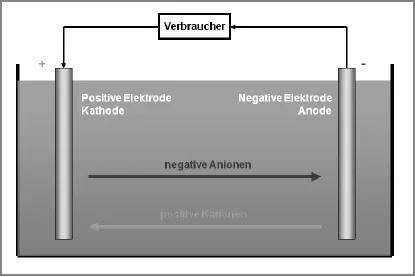
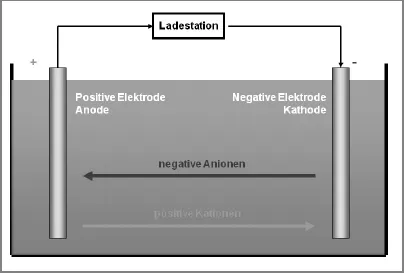
Ein Akku besteht aus zwei Elektroden aus verschiedenen Metallen, die in eine leitende Flüssigkeit eingetaucht sind. Sie werden Anode und Kathode genannt. Bei Einwegbatterien entspricht die Anode der negativen Elektrode, die Kathode der positiven. Beim Akku kommt es auf den Betriebszustand an, welche Funktion Anode und Kathode ausüben. Wird Strom entnommen, entspricht auch beim Akku die Anode dem negativen und die Kathode dem positiven Pol. Wird der Akku geladen, wird aus der negativen Elektrode die Kathode und aus der positiven die Anode.
Die beiden in eine leitende Flüssigkeit getauchten Elektroden sind in der Lage, im Zuge einer chemischen Reaktion Elektronen abzugeben oder aufzunehmen. Elektronen sind negativ geladene Elementarteilchen. In Atomen bilden sie die Elektronenhülle, von wo sie leicht an andere Atome abgegeben oder von anderen Atomen kommend aufgenommen werden können. Je nachdem, ob ein Atom einen Elektronenüberschuss oder -mangel hat, ist es positiv oder negativ geladen. Positiv geladene Ionen werden auch Kationen, negativ geladene Anionen genannt.
Ist am Akku ein elektrischer Verbraucher angeschlossen, ist der Stromkreis geschlossen. Nun übernimmt der Elektrolyt den Transport elektrischer Ladungen. Wird der Akku entladen, wandern positiv geladene Kationen von der negativ geladenen Anode zur positiv geladenen Kathode. Gleichzeitig wandern negativ geladene Anionen von der Kathode zur Anode.
Wird der Akku geladen, kehrt sich der Vorgang um und positive Kationen wandern von der positiv geladenen Anode zur negativen Kathode. Von dieser wandern gleichzeitig negative Anionen zur Anode.
2.3 Elektrolyt
Ein Elektrolyt ist eine flüssige, gelartige oder feste Substanz, die in der Lage ist, Ionen aufzunehmen, abzugeben und zu transportieren. Der Elektrolyt sorgt im Inneren eines Akkus oder einer Batterie für den Ionentransport zwischen den positiv und negativ geladenen Elektroden.
Im Bleiakku kommt als Elektrolyt 30- bis etwa 37-prozentige Schwefelsäure zum Einsatz. Im Nickel-Kadmium- und Nickel-Metallhydrid-Akku dient Kalilauge als Elektrolyt. Der Lithium-Ionen-Akku verwendet Alkohol-Karbonate. In Lithium-Polymer-Akkus werden organische Elektrolyten in einer Kunststoffmatrix verwendet.
2.4 Separatoren
Separatoren haben die Aufgabe, die unterschiedlich geladenen Elektroden elektrisch voneinander zu isolieren. Sie bestehen aus dünnen isolierenden Materialien wie verschiedenen Kunststoffen, Glasfaser oder Vlies. Die besondere Herausforderung besteht darin, dass Separatoren einen sehr geringen Innenwiderstand haben müssen, um die zwischen den Elektrodenplatten wandernden Ionen auf ihrem Weg nicht zu behindern.
Separatoren kommen bei allen Akkutypen zum Einsatz. Je nach Aufbau bestehen sie aber aus unterschiedlichen Materialien. In der Vergangenheit kamen Gewebe und Papier zum Einsatz, heute bestehen sie aus feinporigen Materialien.
In Bleiakkus wird als Separatormaterial extrudiertes oder gesintertes Polyethylen oder gesintertes PVC verwendet. In AGM-Akkus wird primär ein Mikroglasfaservlies eingesetzt.
Kombinationen aus Polyamid mit Polyethylen oder Polypropylen sind die klassischen Separatoren in Nickel-Kadmium-Akkus. Sie haben durchweg die Form von Vliesstoffen.
Grundsätzlich kommen auch in Nickel-Metallhydrid-Akkus als Separatoren die gleichen Materialien zum Einsatz. Zur Verringerung der Selbstentladung wird die Vliesoberfläche jedoch zusätzlich z. B. mit Acrylsäure behandelt.
In Lithiumakkus bilden mikroporöse Membranen in Form von polymeren Folien die Separatoren. Diese können auch in mehreren Schichten aufgebaut sein. Da solche Folien nur bis etwa 120 °C hitzebeständig sind, können für Akkus für den stationären Einsatz auch mikroporöse keramische Separatoren eingebaut sein. Diese sind zwar hitzebeständig, aber bruchempfindlich.
Im Hinblick auf den künftigen Einsatz der Lithiumakkus in Elektrofahrzeugen aller Art arbeitet man derzeit an der Entwicklung eines mit Keramik beschich...