
eBook - ePub
Los materiales nanoestructurados
Sus propiedades y aplicaciones en la revolución científica y tecnológica del siglo XXI
José Luis Morán Lopez, José Luis Rodríguez López
This is a test
Share book
- 151 pages
- Spanish
- ePUB (mobile friendly)
- Available on iOS & Android
eBook - ePub
Los materiales nanoestructurados
Sus propiedades y aplicaciones en la revolución científica y tecnológica del siglo XXI
José Luis Morán Lopez, José Luis Rodríguez López
Book details
Book preview
Table of contents
Citations
About This Book
Esta obra aborda el comportamiento de los materiales con dimensiones en el rango de los nanómetros, describe algunas técnicas que se usan para sintetizar estos materiales así como para su caracterización. Por último, se discuten algunas de las propiedades fisicoquímicas más relevantes de estos sistemas, y la aplicación tecnológica presente y futura de estos materiales. La presente monografía tiene como finalidad motivar a estudiantes de las áreas de física, química e ingeniería, en el estudio y desarrollo de los materiales nanoestructurados.
Frequently asked questions
How do I cancel my subscription?
Can/how do I download books?
At the moment all of our mobile-responsive ePub books are available to download via the app. Most of our PDFs are also available to download and we're working on making the final remaining ones downloadable now. Learn more here.
What is the difference between the pricing plans?
Both plans give you full access to the library and all of Perlego’s features. The only differences are the price and subscription period: With the annual plan you’ll save around 30% compared to 12 months on the monthly plan.
What is Perlego?
We are an online textbook subscription service, where you can get access to an entire online library for less than the price of a single book per month. With over 1 million books across 1000+ topics, we’ve got you covered! Learn more here.
Do you support text-to-speech?
Look out for the read-aloud symbol on your next book to see if you can listen to it. The read-aloud tool reads text aloud for you, highlighting the text as it is being read. You can pause it, speed it up and slow it down. Learn more here.
Is Los materiales nanoestructurados an online PDF/ePUB?
Yes, you can access Los materiales nanoestructurados by José Luis Morán Lopez, José Luis Rodríguez López in PDF and/or ePUB format, as well as other popular books in Tecnología e ingeniería & Nanotecnología y MEMS. We have over one million books available in our catalogue for you to explore.
Information
Subtopic
Nanotecnología y MEMSIV. PROPIEDADES FISICOQUÍMICAS DE NANOESTRUCTURAS
INTRODUCCIÓN
Como ya se mencionó, las propiedades fisicoquímicas de los materiales nanoestructurados no son interpolaciones entre las propiedades atómicas y las de los sistemas macroscópicos; son propiedades únicas que dependen de su estructura geométrica, el número de átomos que los componen y, en el caso de sistemas con más de un elemento químico, de cómo se acomodan las diferentes componentes espacialmente. En este capítulo describiremos algunas de esas propiedades, empezando por la estabilidad espacial. Todas las propiedades de las nanoestructuras dependen en forma determinante de la estructura geométrica que adoptan. Después abordaremos las propiedades electrónicas, las magnéticas y las ópticas.
PROPIEDADES ESTRUCTURALES
La forma geométrica que adoptan las estructuras nanométricas depende del tipo de elemento químico, del número de átomos en el sistema y de la temperatura. El número de diferentes arreglos geométricos para un número de átomos dado de determinado elemento químico es enorme, y encontrar el de menor energía es una tarea compleja. Este número se reduce si suponemos que la temperatura a la que se halla el sistema es cero kelvin. Para calcular el estado base (cero kelvin) se han desarrollado muchos métodos de química cuántica y de ciencia de materiales. Aquí sólo presentaremos los resultados que gozan del consenso de la comunidad científica, sin abundar en aspectos técnicos.
A continuación exponemos sólo tres tipos de materiales nanoestructurados: los formados sólo por átomos de carbono, las estructuras de metales alcalinos y las constituidas por metales de transición.
Estructuras de carbono
El carbono es un elemento con gran capacidad para ligarse químicamente a otros átomos, tanto de carbono mismo como de otros elementos. La característica que los distingue es que sus compuestos moleculares adoptan la forma de cadenas o anillos. Es tan rica la variedad de tales compuestos que a la fecha se ha sintetizado más de un millón y se siguen preparando más cada día. Los electrones que participan en los enlaces químicos son del tipo s y p, que tienen la propiedad de formar enlaces en direcciones bien determinadas.
Prueba de ello es que en sistemas macroscópicos el carbono puede adoptar las formas de diamante o de grafito. En la primera, cada átomo está ligado a otros cuatro en forma de tetraedros regulares. Por otro lado, el grafito es un arreglo anisotrópico, en el cual tres de los enlaces químicos forman arreglos atómicos bidimensionales con estructura hexagonal. Estas láminas, llamadas grafeno, se unen muy débilmente unas con otras y es posible desplazarlas con facilidad.
En la década de 1990 este panorama cambió al sintetizarse otro tipo de carbono sólido completamente diferente al diamante y al grafito. En contraste con los otros sólidos, éste tiene como unidades no sólo un átomo sino moléculas gigantes de 60 átomos de carbono ubicadas en los vértices de una red cúbica. A este arreglo cristalino se le conoce como C60-sólido o fullerita.
Las moléculas con forma geodésica
Las primeras moléculas aisladas C60 fueron producidas y reportadas en 1984 por Eric A. Rohlfing (Rohlfing et al., 1984). En ese momento no se conocía la forma de organización espacial de los 60 átomos de carbono. Fue hasta el año siguiente cuando Kroto y sus colaboradores propusieron que los átomos estaban ubicados en los vértices de un icosaedro truncado (Kroto et al., 1985). En la figura IV.1a se muestra la estructura de la molécula de 60 átomos.
Consideramos importante hacer un breve recuento histórico del descubrimiento de las moléculas C60, ya que este hallazgo proporcionó el auge que actualmente tienen la nanociencia y sus aplicaciones.
Como sucede a menudo en la ciencia, los descubrimientos se dan de una manera completamente inesperada. En este caso, el descubrimiento de la molécula C60 fue motivado por estudios de la materia interestelar. En 1968, Charles Townes (1915) demostró que las nubes oscuras de la Vía Láctea están formadas por moléculas complejas, muchas de ellas con carbono como parte esencial de su estructura.
Por otro lado, Harry Kroto, profesor de la Universidad de Sussex, en Inglaterra, se propuso investigar la existencia de moléculas largas de carbono del tipo HCnN en esa región del espacio. En una exitosa colaboración con radioastrónomos canadienses, logró detectar moléculas con 5, 7 y 9 carbonos.
Posteriormente, en 1984 Kroto conoció a Rick Smalley en una visita a la Universidad de Rice, en Houston, Texas. Smalley, profesor de esa universidad, se dedicaba a la producción y estudio de cúmulos pequeños de materiales semiconductores. La técnica de síntesis desarrollada por él se basa en la evaporación de átomos de un material sólido calentado a temperaturas muy altas por medio de una rayo láser. Este procedimiento de síntesis se describe en el capítulo II.
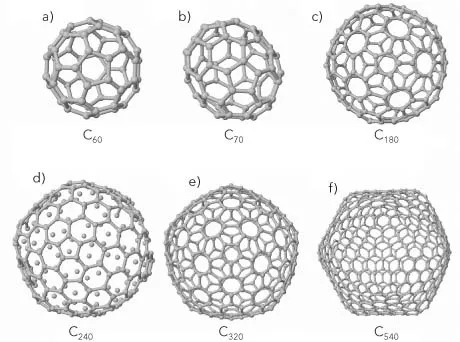
FIGURA IV.1. Estructuras geométricas de las moléculas huecas o fullerenos de carbono: a) C60; b) C70; c) C180; d) C240; e) C320, y f) C540 átomos, respectivamente.
Al conocer Kroto la técnica con la que se generaban los pequeños agregados atómicos, pensó que al usar como blanco una muestra de grafito se podría simular el tipo de reacciones que ocurren en el espacio interestelar. De tener éxito esta propuesta, se podrían producir, bajo condiciones controladas, las largas cadenas de carbono observadas en esa región del espacio y entender algunos procesos de la formación planetaria.
Poco antes de la realización de los experimentos, investigadores de la compañía petrolera Exxon, interesada en catalizadores, generaron cúmulos de carbono por un proceso similar al de Smalley, usando grafito como blanco. Analizaron los cúmulos generados con un número de átomos que variaba entre 30 y 190. Lo interesante de sus estudios fue haber encontrado que sólo se formaban cúmulos con un número par de átomos.
Al realizar el experimento en Rice, en septiembre de 1984, Smalley, Kroto y colaboradores corroboraron los resultados del grupo de Exxon, pero además notaron una clara abundancia de agregados de 60 y 70 átomos. La gráfica de los resultados experimentales se muestra en la figura II.13; ahí se aprecia la abundancia de cúmulos formados con un determinado número de átomos de carbono como función de ese número de átomos. Los máximos que sobresalen corresponden a C60 y C70.
Después de verificar varias veces los resultados experimentales, la pregunta que se plantearon fue: ¿cómo están organizados geométricamente esos 60 átomos? Dada la gran estabilidad de esas moléculas, que mostraban una reactividad muy reducida, llegaron a la propuesta de que debían de tener la forma de esferoide. Una estructura de ese tipo se asemejaría a los arreglos atómicos tipo grafito y, por lo tanto, no tendría enlaces sin saturar que emergieran radialmente del esferoide y adquirieran así un rol químico. Esta idea explicaba la poca reactividad y la alta estabilidad que mostraban estas moléculas.
Al recordar la estructura geodésica construida por el arquitecto Buckminster Fuller en la Exposición Universal de 1967, de Montreal, Kroto propuso que la molécula tal vez tenía una estructura similar, formada por hexágonos y pentágonos. Un arreglo geométrico con tales características y 60 vértices corresponde a un icosaedro truncado (figura IV.1a); de ahí nació el nombre de fullereno para la molécula C60 y otros sistemas huecos similares.
Las estructuras geométricas que adoptan los agregados con un número reducido de átomos de carbono son sorprendentes; la estructura de la molécula C60, una estructura hueca con forma de icosaedro truncado, consiste en 12 pentágonos, 20 hexágonos, 60 vértices, 32 caras y 90 aristas. Ésta era la molécula de carbono puro mas exótica, extraña y elegante conocida en el momento de su descubrimiento.
Los fullerenos gigantes
Para mayor sorpresa, se han encontrado estructuras gigantes anidadas en torno al C60, con la misma geometría (Iijima, 1987). Ésta se ...