![]()
Capitolo 1
Market access
Lo stato si propone di assicurare un’adeguata assistenza sanitaria con infrastrutture e servizi attuando scelte economiche per uno sviluppo equilibrato ed equo di ogni settore della sanità.
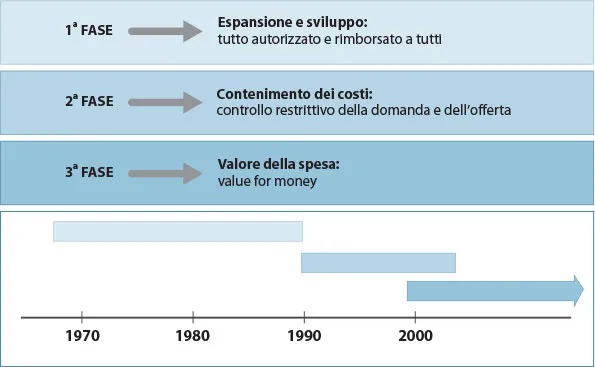
Nell’ultimo cinquantennio l’evoluzione dei sistemi di sanità ha seguito tre fasi principali (figura 1.1) in relazione all’espansione della domanda e dell’offerta; fasi dettate dalle risorse disponibili e modulate sulla sostenibilità economica dell’evoluzione della domanda determinata dalle variabili demografiche.
Figura 1.1 Fasi evolutive dello sviluppo dei sistemi sanitari. (Fonte: Gianfrate, 2013)
Oggi siamo in una fase avanzata di richiesta di dimostrazione del valore delle prestazioni e dei farmaci pagati dal Servizio sanitario nazionale (SSN).
I farmaci, benché assorbano solo una quota all’incirca del 16% della spesa sanitaria pubblica, costituiscono il presidio terapeutico più utilizzato e quindi maggiormente soggetto alle dinamiche demografiche di invecchiamento, cronicizzazione delle malattie e desiderio di benessere.
La principale criticità dei farmaci è la compatibilità tra spesa pubblica per l’assistenza farmaceutica di qualità, equità nell’accesso senza discriminanti per ogni assistito e remunerazione per l’industria che li scopre e li produce.
In tali compatibilità e sostenibilità, insieme alla possibilità di applicare industrialmente le nuove conoscenze scientifiche, sono racchiuse le specificità del farmaceutico
Nella logica di contenimento della spesa pubblica, la spesa farmaceutica risulta finanziariamente più facile da comprimere rispetto ad altre voci con componenti strutturali e infrastrutturali sulle quali è più difficoltoso intervenire restrittivamente (spesa ospedaliera, personale dipendente ecc.). Le misure di contenimento della spesa farmaceutica riguardano in genere sia la domanda sia l’offerta.
La domanda viene contenuta prevalentemente attraverso una compartecipazione alla spesa del privato (ticket) o vincolando le prescrizioni a determinate patologie e/o pazienti tramite note restrittive (note AIFA) alle prescrizioni stesse e interventi sulle esenzioni per età, reddito e patologia.
Il controllo della domanda mira a ridurre la spesa anche attraverso la correzione dei comportamenti prescrittivi dei medici, in modo che la scelta di una terapia al posto di un’altra tenga conto anche dell’impatto sulla spesa pubblica. Il controllo delle prescrizioni può avvenire in quattro modi:
–limitando il budget massimo di spesa del singolo medico;
–attraverso controlli periodici e limitazioni delle prescrizioni;
–attraverso linee guida prescrittive;
–incentivando l’uso dei generici.
La prima misura è adottata per lo più in Germania e nel Regno Unito, dove vige la libertà di prezzo, perciò si va a incidere più sulla domanda che sull’offerta.
Il controllo delle prescrizioni è invece un iter consolidato in quasi tutti i paesi europei, ma essendo la libertà di prescrizione un valore difeso dai medici, in genere si preferisce intervenire a monte sul numero di confezioni per ricetta e di prescrizioni emesse.
Sta crescendo l’interesse per la terza misura, le linee guida, forme di controllo che suggeriscono gli iter terapeutici e prescrittivi. Le linee guida sono formulate da esperti appartenenti allo stesso mondo medico.
Gli interventi più significativi ed efficaci si concentrano sull’offerta, riducendo i prontuari e i prezzi pagati dal SSN a produttori e distributori. In Italia ciò avviene in modo diretto e indiretto con decreti di taglio, revisione dei prontuari, spostamento dei farmaci nella fascia di non rimborsabilità, imponendo sconti ai produttori e ai distributori, intervenendo sulla distribuzione, imponendo budget a vari livelli con restituzione degli importi che superano i tetti definiti, o pay back, con forme di negoziazione atipiche come il risk sharing, il payment by result ecc.
Queste misure hanno un forte effetto contenitivo sulla spesa SSN ma gravano pesantemente sulla filiera, incidendo negativamente sul conto economico delle aziende, dei distributori, delle farmacie e dell’indotto.
Tra i principali interventi normativi di controllo della spesa farmaceutica SSN dal 2001 si ricordano:
–tagli ripetuti del prezzo per decreto;
–riduzione del CPC;
–nuovo prontuario con prezzo per ATC;
–extra sconti della distribuzione;
–distribuzione diretta e per conto e PHT;
–tetti di spesa, budget aziendali, pay back.
Vale la pena evidenziare, tra le principali misure adottate, l’istituzione di tetti per la spesa convenzionata e quella ospedaliera e di tetti di fatturato per le singole aziende e il singolo prodotto immesso in commercio, che associati al conseguente pay back in caso di sforamento disegnano un meccanismo autoregolato a rimanere nei budget di spesa pubblici previsti. Va ricordato a tale proposito che il pay back, non avendo misure parallele di contenimento della domanda/prescrizione, porta al pagamento da parte delle imprese di un certo numero di trattamenti di pazienti.
Analogamente la distribuzione diretta e per conto, insieme agli sconti obbligatori imposti alla distribuzione, ha pesantemente gravato sui conti delle farmacie.
Regolazione e accesso al mercato
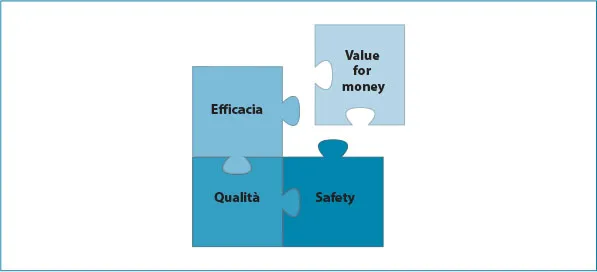
Nel processo di introduzione di un nuovo farmaco sul mercato, tradizionalmente le dimostrazioni che il titolare del brevetto deve fornire alle autorità preposte alle decisioni di accesso al mercato erano di carattere scientifico-clinico. Nell’ormai cronico contesto di controllo e restrizione della spesa pubblica, alla dimostrazione del plusvalore clinico-medico si è aggiunta la richiesta di valutazione del valore economico del “beneficio” che il nuovo farmaco può apportare, ovvero il value for money, il valore farmacoeconomico (figura 1.2).
L’ottimizzazione del rapporto tra costi e risultati deve tenere in considerazione la prospettiva dell’ambito del processo regolatorio o decisionale, sia esso macro o micro, a cui tale rapporto si applica.
Nella fase iniziale, gli attori principali sono le autorità regolatorie, coinvolte nelle decisioni generali che influenzano sia l’accessibilità ai farmaci (prezzo e rimborsabilità), sia l’uso appropriato degli stessi. Successivamente, durante il processo di regolamentazione, sono coinvolti nelle decisioni anche gli altri attori del sistema di assistenza sanitaria (ad esempio le regioni, i singoli e le unità sanitarie locali, con i rispettivi prontuari locali e ospedalieri o linee guida prescrittive), fino alla fase finale rappresentata da una prescrizione medica per il paziente.
Analizziamo queste fasi a partire dall’esito della ricerca clinica, quando con il dossier registrativo l’azienda titolare del brevetto è pronta a richiedere alle autorità competenti di accedere al mercato.
Figura 1.2 Value for money. (Fonte: Gianfrate, 2013)
Autorizzazione all’immissione in commercio
Completato lo sviluppo di fase III, l’impresa raccoglie tutti i dati prodotti fino a quel momento in un dossier da sottoporre alle autorità per la revisione, prima della concessione dell’autorizzazione all’immissione in commercio. Anche la compilazione di questi documenti è generalmente sottoposta a norme che ne regolano i contenuti e la forma. L’analisi del dossier registrativo è una fase importante sia per l’intero processo di sviluppo sia per i tempi di valutazione della documentazione, che rallentano la registrazione del farmaco.
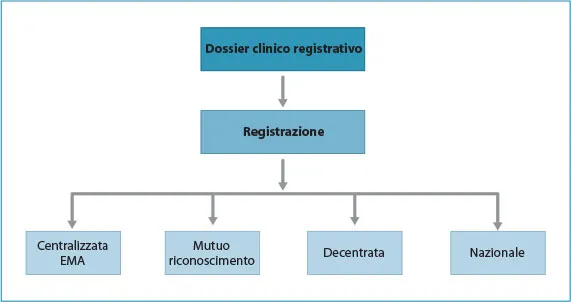
Le tipologie di autorizzazione sono europee (centralizzata, mutuo riconoscimento, decentrata) o nazionali per alcuni casi specifici (figura 1.3).
Figura 1.3 Tipologie di autorizzazione all’immissione in commercio. (Fonte: Gianfrate, 2014)
Il carattere vincolante delle procedure di autorizzazione comunitarie è limitato alla registrazione del farmaco e non riguarda la rimborsabilità, materia delle singole autorità nazionali. Le due agenzie preposte a concedere l’autorizzazione all’immissione in commercio (AIC) di un nuovo farmaco o di modifiche a un farmaco sono l’Agenzia Europea per i Medicinali (EMA, European Medicines Agency), per l’intera Unione Europea, e l’Agenzia Italiana del Farmaco (AIFA), con prevalenti responsabilità di attribuzione del prezzo e rimborsabilità da parte del nostro Servizio sanitario nazionale.
L’E...