![]()
1
Einführung
1.1 Definitionen
Die Aufgaben der Elektrochemischen Verfahrenstechnik (ECVT) sind die Beschreibung und Entwicklung von Verfahren für die Stoff- und Energieumwandlung mit Hilfe von elektrochemischen Reaktionen. Die ECVT stellt damit einen Zweig der chemischen Verfahrenstechnik dar, in der die Stoffumwandlungen in chemischen Reaktoren im Mittelpunkt stehen. Die Optimierung eines Verfahrens beinhaltet die Analyse der physikalisch-chemischen Prozesse in einem elektrochemischen Reaktor, die Beachtung des Stoff- und Energieeinsatzes sowie die Quantifizierung der Kosten für Bau, Betrieb und Instandsetzung der Anlage.
Die wissenschaftlich-technische Grundlage für die verfahrenstechnische Analyse liefert die Elektrochemie, in der die physikalisch-chemischen Phänomene an der Phasengrenze zwischen der Elektrode und dem Elektrolyten als Ort des chemischen Umsatzes behandelt werden. Die Anwendung dieser Gesetzmäßigkeiten führt zur elektrochemischen Reaktionstechnik, die zum Ziel hat die entsprechenden Reaktoren mit ihren Komponenten auszulegen, zu konstruieren und den Betrieb mit Hilfe von mathematischen Modellen zu beschreiben.
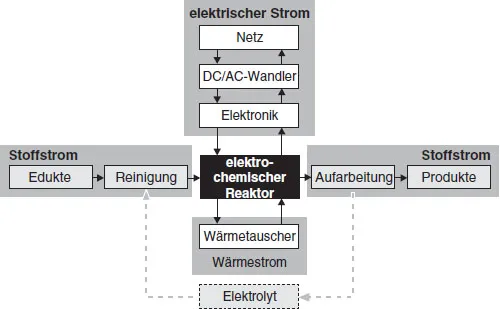
Das Charakteristische der Elektrochemie ist, daß chemische Reaktionen unter Beteiligung von Elektronen ablaufen, die durch einen äußeren Leiterkreis fließen. Ein Reaktionspartner in einer elektrochemischen Reaktion ist stets eine Elektrode, die Elektronen entweder aufnimmt oder abgibt. Das hat für die ECVT zur Folge, daß neben der Masse und Energie zusätzlich die Ladung bzw. der Stromfluß bilanziert werden muß. In Abb. 1.1 sind die Ströme dieser drei Bilanzgrößen beim Betrieb eines elektrochemischen Reaktors schematisch dargestellt.
Durch Zufuhr von elektrischer Energie werden chemische Stoffumwandlungen im elektrochemischen Reaktor durchgeführt. Die Schnittstelle zwischen dem wechselstromführenden Netz des Energieversorgungsunternehmens und dem Reaktor in einem Betrieb ist ein sogenannter AC/DC-Wandler, der die hohe Wechselspannung heruntertransformiert und den Reaktor mit Gleichstrom versorgt.
Andererseits kann in einem elektrochemischen Reaktor auch chemische in elektrische Energie umgewandelt werden. In diesem Fall liegt ein galvanisches Element (eine Batterie oder eine Brennstoffzelle) vor und elektrische Energie kann in Form von Gleichstrom über eine angepaßte Leistungselektronik (DC/AC-Wandler) in das Wechselstromnetz eingespeist werden (siehe Abb. 1.1).
Im Gegensatz zum äußeren elektrischen Leiterkreis wird der Strom innerhalb eines elektrochemischen Reaktors durch Ionen in einem meist flüssigen Elektrolyten transportiert. Der Elektrolyt stellt in allen elektrochemischen Reaktoren somit ein wertvolles Betriebsmittel dar, in dem darüber hinaus die Edukte und Produkte gelöst und transportiert werden und wo vor- oder nachgelagerte chemische Reaktionen stattfinden können. Bei der Aufarbeitung der Produkte sollte er wieder in den Prozeß zurückgeführt werden. Deshalb sollte ein flüssiger Elektrolyten im Kreis geführt und die Produkte durch entsprechende Maßnahmen abgetrennt werden können. Die Abtrennung der Produkte kann durch den Einsatz sogenannter Festelektrolyte, bei denen der Elektrolyt beispielsweise in einer polymeren Matrix fixiert ist, vereinfacht werden.
Die Einbindung des elektrochemischen Reaktors in die peripheren Baueinheiten, wie Leitungen, Einheiten zur Förderung der Edukte, der Produkte und der Betriebsstoffe, mit je nach Bedarf weiteren verfahrenstechnischen Schritten führt zum gesamten elektrochemischen Produktionsprozeß.
1.2 Arbeitsweise in der Elektrochemischen Verfahrenstechnik
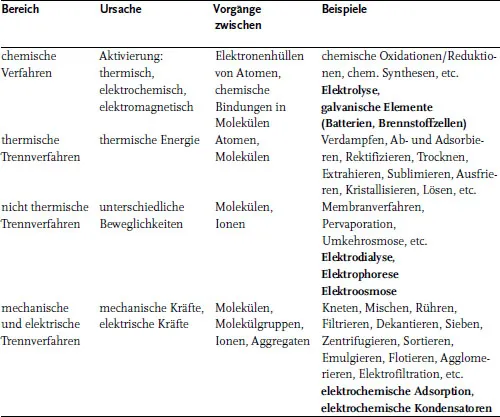
In der verfahrenstechnischen Beschreibung einer Produktionsanlage teilt man die einzelnen Prozeßschritte in verfahrenstechnische Grundoperationen (unit operations) ein (siehe Tab. 1.1).
Tab. 1.1 Einteilung der Grundoperationen in der chemischen und elektrochemischen Verfahrenstechnik (unit operations)
In einem elektrochemischen Produktionsverfahren gibt es in Analogie zur konventionellen chemischen Verfahrenstechnik verschiedene Prozeßschritte, um von den Eingangsstoffen zu einem verkaufsfähigen Produkt zu gelangen:
1. Lagerung der Eingangs- und Betriebsstoffe
2. Vorbereitung bzw. Reinigung der Eingangsstoffe (Edukte)
3. Durchführung der elektrochemischen Reaktion in einem geeigneten Reaktor
4. Aufarbeitung der Produkte und Rückführung des Elektrolyten in den Stoffkreislauf
5. Formgebung der Produkte für den Vertrieb und die Lagerung
6. Transport des Produkts zum Kunden
Das Design, die Charakterisierung und der Betrieb eines elektrochemischen Reaktors und seine Integration in einen Betrieb sind die eigentlichen Aufgaben des elektrochemischen Verfahrenstechnikers. In der oben genannten Prozeßkette können jedoch mit Blick auf Tab. 1.1 weitere elektrochemische Verfahren zum Einsatz kommen. Hierzu zählen z. B. die elektrochemischen Trennverfahren, die nicht nur in der ECVT angewendet werden, sondern überall zur Vor- oder Nachbehandlung von Stoffen in der chemischen und pharmazeutischen Industrie sowie in der Lebensmittel- und Umwelttechnik eingesetzt werden können.
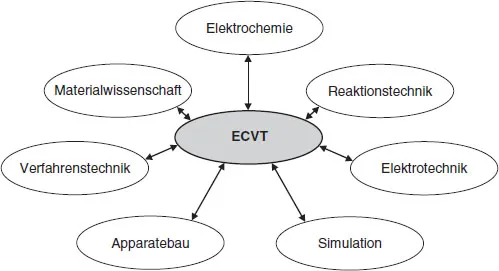
Der in der ECVT arbeitende Ingenieur muß für die Verfahrensbeschreibung viele Aspekte aus unterschiedlichen Disziplinen berücksichtigen. Die physikalischchemischen Grundlagen aus der Elektrochemie sind genauso wichtig wie ingenieurwissenschaftliche Arbeitsmethoden und die Materialwissenschaften (siehe Abb. 1.2). Durch den Einsatz immer leistungsfähigerer Computer und der Entwicklung angepaßter Simulationsprogramme können arbeits- und kostenintensive Experimente ersetzt werden. Hierzu gehört die mathematische Simulation der physikalisch- chemischen Vorgänge an Komponenten eines Reaktors wie den Elektroden und dem Elektrolyten (mikromodelling) und/oder des gesamten Prozesses (makromodelling).
Die ECVT ist deshalb eine interdisziplinär ausgerichtete, angewandte Wissenschaft, in der man nur in Teamarbeit mit den Ingenieuren anderer Fachgebiete zum Erfolg kommen kann. Die ingenieurmäßigen Aufgaben in der ECVT können damit wie folgt stichwortartig zusammengefaßt werden:
- Auslegung, Konstruktion und Design von elektrochemischen Reaktoren für neue elektrochemische Herstellungsverfahren
- Betrieb, mathematische Modellierung und Optimierung von Reaktoren
- Übertragung neuer elektrochemischer Verfahren aus dem Labor- in den Produktionsmaßstab
- Verfahrensentwicklung und Optimierung, Reaktorintegration in die Peripherie, Aufarbeitung der Edukte und Produkte, Sicherheitstechnik
- Verfahrensbeschreibung mit Kenngrößen, Verfahrensfließbildern und Ablaufdiagrammen und Überwachung der gesamten Anlage
- betriebswirtschaftliche Betrachtungen (Kosten für Anlageninvestitionen, Betriebs- und Instandsetzungskosten, Energiekosten)
Auf weitere Aspekte der ECVT wird nach der Behandlung der elektrochemischen und reaktionstechnischen Grundlagen in Kap. 5 eingegangen.
1.3 Elektrochemische Verfahren in Chemie und Technik
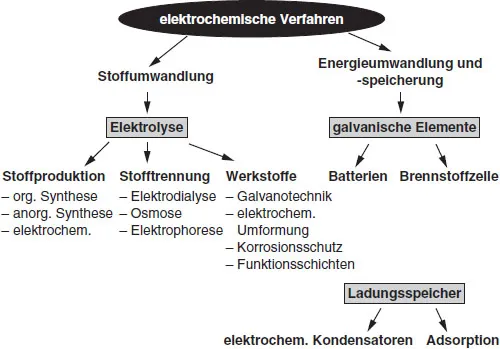
Elektrochemische Verfahren findet man in vielen Bereichen der Chemie und Technik. Sie werden zur Produktion und Trennung von Stoffen, zur Modifizierung von Werkstoffen und zur Speicherung und Umwandlung von Energie angewendet. Eine Einteilung der verschiedenen Verfahren ist in Abb. 1.3 gegeben. Sie erfolgt in erster Linie nach der elektrischen Energiebilanz: Während Elektrolyseverfahren sich dadurch auszeichnen, daß sie elektrische Energie zur Stoffproduktion verbrauchen und die chemischen Produkte im Vordergrund stehen, ist bei der elektrochemischen Energieumwandlung und -speicherung die elektrische Energie die wichtigste Bilanzgröße. Auf diese thermodynamisch begründete Einteilung wird näher in Abschnitt 2.2 eingegangen. Eine Sonderstellung nehmen hierbei die Ladungsspeicher ein. Bei einem elektrochemischen Kondensator oder bei der elektrochemisch induzierten Adsorption ist der Stromfluß nicht mit elektrochemischen Reaktionen gekoppelt, sondern es werden lediglich bei Stromfluß ionische Ladungsträger zwischen der Elektrode/Elektrolyt-Phasengrenze und dem Elektrolyten ausgetauscht (siehe dazu Abschnitt 2.3.3).
Die Herstellung eines chemischen Produkts mit Hilfe eines elektrochemischen Verfahrens erfordert den Einsatz von elektrischer Energie. Diese ist im allgemeinen eine „edle“Energieform, die durch Umwandlung von chemischer Energie fossiler Energieträger, wie Kohle, Erdöl oder Erdgas, oder aus Kernenergie gewonnen werden muß. Die Bereitstellung von Elektrizität ist technologisch aufwendig und kostenintensiv. Die Energiekosten müssen deshalb bei der Wahl eines Standorts für eine elektrochemische Groß produktion berücksichtigt werden. So haben Länder wie beispielsweise Norwegen oder Kanada, die über billige Wasserkraft zur Strombereitstellung verfügen, deutliche Vorteile bei der sehr energieaufwendigen Aluminium- Schmelzfluß elektrolyse. Deshalb ist hier die Minimierung des spezifischen elektrischen Energieverbrauchs für das Produkt eine der wichtigsten verfahrenstechnischen Aufgaben.
Hinsichtlich einer Ökobilanz gelten elektrochemische Verfahren bezogen auf ihren Standort in vielen Fällen als umweltfreundlich, weil die Emissionen durch höhere Effizienz und bedingt durch milde Prozeß bedingungen im Vergleich zu konventionellen Verfahren geringer sind. Ein Beispiel hierfür ist die z. Z. stark in der Entwicklung befindliche Brennstoffzellentechnologie. Wenn man jedoch die zur Zeit noch verwendeten fossilen Energieträger in die Bilanz mit einbezieht, sind elektrochemische Verfahren auch mit der Emission von Schadstoffen verbunden. Bei der Anwendung von regenerativen Energieumwandlungstechniken wie z. B. Wind- und Wasserkraft oder Photovoltaik wäre jedoch ein elektrochemisches Verfahren als nachhaltig zu bewerten. Für eine nachhaltige Energiewirtschaft steht darüber hinaus die Wasserstofftechnologie mit Wasserstoff als sekundärem Energieträger, der durch Wasserelektrolyse unter Verwendung regenerativer Energien erzeugt wird und bei Bedarf zur Bereitstellung von Elektrizität und Wärme mit Hilfe von Brennstoffzellen dient (siehe dazu Kap. 7).
Elektrochemische Verfahren stehen immer in Konkurrenz zu den konventionellen Techniken. Bei den Elektrolyseverfahren sind es die chemischen Syntheseverfah...