![]()
1
Einleitung
Die Festkörperphysik ist erst in der Mitte des vorigen Jahrhunderts zu einer eigenständigen Disziplin der Physik geworden. Inzwischen hat sie sich zu deren größten und in mancher Hinsicht wichtigsten Teilbereich entwickelt. Vorher, in der ersten Jahrhunderthälfte, standen die Metalle im Vordergrund des Interesses. Zusammen mit der zunehmenden praktischen Bedeutung entwickelte sich das theoretische Verständnis dieser Materialien. In der zweiten Jahrhunderthälfte nahmen dann die anorganischen Halbleiter und die Supraleiter den Metallen ihren Spitzenplatz an Interesse in Forschung und Anwendung von neuen Materialien ab. Manches spricht dafür, dass nun im 21. Jahrhundert eine neue Gruppe von Materialien ähnlich interessant und wichtig wird: die organischen Festkörper.
Jedenfalls hat in jüngster Zeit in dem breiten Spektrum der Festkörperforschung die Untersuchung der physikalischen Eigenschaften der organischen Festkörper sehr an Bedeutung und an Interesse gewonnen. Die reiche Vielfalt dieser Verbindungen und die Möglichkeit, sie mit den Methoden der synthetischen organischen Chemie immer weiter zu modifizieren, geben Anlass zu großen Erwartungen in die Entwicklung neuer Materialien und neuer Anwendungen. Das aktuelle Interesse gilt in besonderem Maße Festkörpern aus denjenigen organischen Molekülen, die konjugierte π-Elektronensysteme enthalten. In diesem Buch wird eine Einführung in die Struktur sowie vor allem in die dynamischen, optischen, elektrischen und elektrooptischen Eigenschaften dieser Stoffgruppe gegeben und an ausgewählten Beispielen wird gezeigt, welche Bedeutung diesen Stoffen in der praktischen Anwendung zukommt.
Diese Einführung kann nur versuchen, die wichtigsten und für organische Festkörper besonders typischen Eigenschaften und Konzepte zu erläutern. Auch muss im Interesse der Kürze an vielen Stellen auf Details der experimentellen Methoden und der Theorien verzichtet werden. Die Referenzen zu den einzelnen Kapiteln sollen den Zugang zu einem intensiveren Verständnis erleichtern. Insbesondere soll aber – dies gilt für das ganze Buch – auf die wenigen ausführlichen Monographien zu diesem Gebiet verwiesen werden: [M1]–[M3].
1.1 Was sind organische Festkörper?
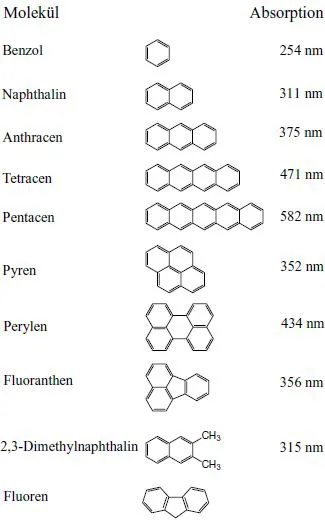
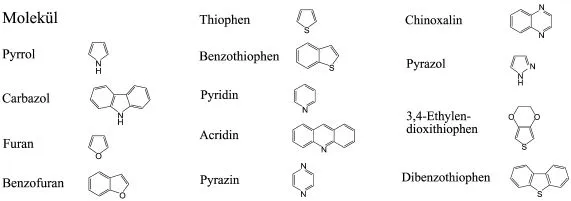
Moleküle oder deren Ionen (Molekülionen oder Radikalionen) aus dem Bereich der Organischen Chemie, das heißt vereinfacht aus Verbindungen mit C-Atomen als wesentlichen Strukturelementen, sind im festen Zustand die Bausteine von Einkristallen, Polykristallen oder Gläsern. Dies sind die organischen Festkörper. Auch die Polymere in fester Phase gehören dazu. Wenn wir im Folgenden von organischen Festkörpern sprechen, dann verstehen wir unter diesem Oberbegriff vielerlei, aber in erster Linie diejenigen organischen Molekülkristalle, Radikalionenkristalle, Charge-Transfer-Kristalle, dünne Schichten oder Schichtstrukturen und Polymere, die konjugierte π-Elektronensysteme in ihrem Gerüst enthalten, welches primär aus C-Atomen aufgebaut ist, oft jedoch auch N-, O-, S- oder Se-Atome enthält. Dazu gehören besonders aromatische Kohlenwasserstoffe und Alkene (Olefine) (Abb. 1.1), aber auch N-, O- oder S-haltige Heterozyklen wie Pyrrol, Furan, Thiophen, Chinoxalin und andere (Abb. 1.2). Auch C60 und damit verwandte Moleküle, wie die C-Nanoröhrchen sind hier zu erwähnen. Die Nanoröhrchen gehören jedoch nicht zu den Materialien, die in diesem Buch behandelt werden. Nur in Ausnahmefällen werden wir aliphatische Kohlenwasserstoffe behandeln, die natürlich auch organische Festkörper bilden, aber keine π-Elektronen sondern nur σ-Elektronen und noch stärker gebundene Elektronen enthalten.
Warum sind Moleküle mit π-Systemen in der organischen Festkörperphysik so besonders interessant? Die Elektronenkonfiguration des freien C-Atoms im Grundzustand ist 1s22s22p2. Dass C vierwertig ist, liegt daran, dass die Elektronenkonfigurationen im gebundenen C sich aus der Konfiguration 1s22s2p3 herleiten. Aus der Molekülphysik wissen wir, dass eine sogenannte Doppelbindung zwischen zwei C-Atomen durch eine sp2-Hybridisierung zustande kommt: Es bilden sich aus einem s- und zwei p-Orbitalen drei entartete Orbitale, die koplanar und um jeweils 120° voneinander unterschieden sind. Chemische Bindungen dieser Orbitale heißen σ – Bindungen. Diese sind lokalisiert. Das vierte Orbital, pz, bleibt unverändert und ist senkrecht zur Ebene der sp2-Orbitale und damit zur Ebene der C-Atome orientiert.
pz -Orbitale benachbarter Orbitale überlappen sich. Das führt zu einer zusätzlichen Bindung, der sogenannten π-Bindung und zu einer delokalisierten Elektronendichte ober- und unterhalb der Ebene des Moleküls. Diese ist Knotenfläche für die π-Elektronendichte.
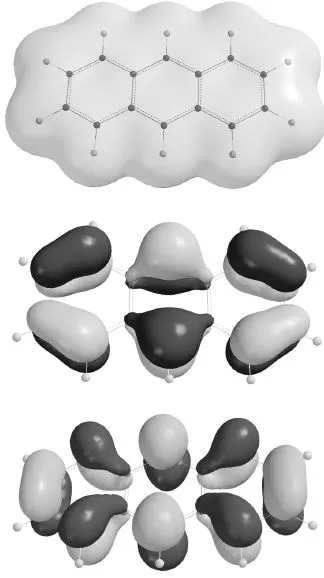
Abb. 1.3 zeigt die gesamte Elektronenverteilung in einem aromatischen Molekül, dem Anthracen. Außer der gesamten Elektronendichte sind in Abb. 1.3 auch zwei π-Orbitale gezeigt, nämlich das energetisch höchste, im Grundzustand besetzte (HOMO) und das energetisch tiefste, im Grundzustand nicht besetzte (LUMO).
Im Vergleich mit den σ -Elektronen ist der Beitrag der π-Elektronen zur Bindung des Moleküls also schwach. Organische Moleküle und Molekülkristalle mit konjugierten π-Elektronensystemen besitzen deshalb elektronische Anregungsenergien im Bereich von nur wenigen eV und absorbieren oder lumineszieren im sichtbaren, nahen infraroten oder nahen ultravioletten Spektralbereich. Dabei verschieben sich die elektronischen Anregungsenergien mit zunehmender Größe des konjugierten Systems zu kleineren Energien, siehe hierzu Abb. 1.1. Die niedersten elektronischen Anregungszustände sind Anregungen der π-Elektronen. Bei den organischen Radikalionenkristallen oder Charge-Transfer-Kristallen sind es ebenfalls die π-Elektronensysteme, die ionisiert sind. Auf deren Existenz beruhen die meisten der charakteristischen physikalischen Eigenschaften der organischen Festkörper, die in diesem Buch behandelt werden. Vor allem gehört dazu die intermolekulare Wechselwirkung, die Van der Waals-Wechselwirkung. Sie wird wesentlich durch die außen liegenden, leicht polarisierbaren und leicht anregbaren π-Elektronen bestimmt.
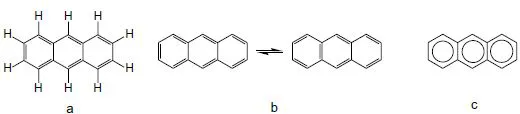
Diese zwischenmolekularen Kräfte, mit denen die Moleküle im festen Zustand zusammengehalten werden, sind bei den Molekülkristallen im allgemeinen schwach, verglichen mit den innermolekularen Kräften. Die Molekülkristalle heißen so, weil die Moleküle als solche im Kristall erhalten bleiben und damit sehr unmittelbar die physikalischen Eigenschaften dieser Stoffe bestimmen. Wie sich ein organischer Molekülkristall dem Auge darbieten kann, zeigt am Beispiel des Anthracens Abb. 1.4.
In der Festkörperphysik ist es häufig üblich und zweckmäßig, sich in der Grundlagenforschung auf die Untersuchung weniger Modellsubstanzen zu konzentrieren. Was man an diesen Substanzen lernt, versucht man dann auf die große Fülle ähnlicher, d.h. zur gleichen Klasse von Stoffen gehöriger Substanzen zu übertragen. Eine Übersicht zu den wichtigsten Stoffklassen, die in diesem Buch behandelt werden, gibt Tab. 1.1.
Wohl am besten Festkörperphysikalisch untersucht sind die Kristalle einfacher aromatischer Kohlenwasserstoffe wie Anthracen oder Naphthalin. Die Strukturformel von Anthracen ist in Abb. 1.5 in verschiedenen üblichen Versionen dargestellt. Für die Aliphaten nehmen wir n-Oktan als Modellsubstanz. Hier liegen die optisch anregbaren Zustände bei wesentlich höheren Quantenenergien als bei den Aromaten, da es hier keine π-Elektronen gibt. Wir werden auf sie in diesem Buch nur wenig eingehen.
Tabelle 1.1: Organische Molekülkristalle und Festkörper, wichtige Stoffklassen und in diesem Buch behandelte charakteristische Beispiele.
| Aliphatische Kohlenwasserstoffe | n-Octan | 2.9 |
| Aromatische Kohlenwasserstoffe | Naphthalin, Anthracen | 1.1, 1.3, 1.4, 2.10, 3.8 |
| Donator-Akzeptor-Komplexe | Anthracen-Tetracyanobenzol (TCNB) | 1.6 |
| schwach, unpolar im | | |
| Grundzustand | | |
| Donator-Akzeptor-Komplexe | Tetrathiafulvalen- | 2.8, 2.17 |
| stark, polar im Grundzustand | Tetracyanoquinodimethan | |
| (TTF-TCNQ) | |
| Radikalionensalze | | 1.7, 1.8, 2.18 |
| | |
| | | |
| Polymere | poly(para-Phenylenvinylen) (PPV) | 11.5 |
| niedermolekulare Schichten | | 11.4 |
| Polymereinkristalle | poly(Diacetylen) (TS6) | 1.10, 1.11 |
Eine weitere wichtige Stoffklasse sind die Donator-Akzeptor-Komplexkristalle. Sie bestehen aus zwei Partnern in stöchiometrischem Verhältnis, von denen der eine auf den anderen Ladung überträgt. Wenn die Ladungsübertragung erst in einem elektronisch angeregten Zustand erfolgt, spricht man von schwachen D-A-Kristallen. Ein gutes Beispiel hierfür ist das Anthracen-Tetracyanobenzol (TCNB) (Abb. 1.6). Der Kristall ist san...