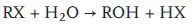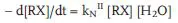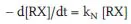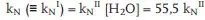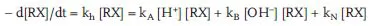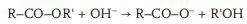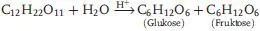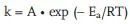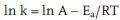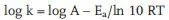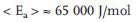![]()
Teil III
Abbau- und Transformationsprozesse
![]()
5
Abbau im Wasser
Der abiotische Abbau, auf dem der Schwerpunkt dieser Abhandlung liegt, erfolgt im Wesentlichen durch zwei Mechanismen bzw. Senken: Hydrolyse und Photolyse (allgemeiner: photochemische Transformation). Während die erste überall dort auftreten kann, wo flüssiges Wasser vorliegt, benötigen photochemische Reaktionen elektromagnetische Strahlung im sichtbaren und ultravioletten Spektralbereich (UV-VIS). Diese lässt besonders in trüben und an Huminstoffen reichen Gewässern zu tieferen Schichten hin stark nach. In diesem Kapitel stehen die Senken in Oberflächengewässern im Vordergrund. Flüssiges Wasser ist jedoch auch in den beiden anderen Umweltmedien Luft und Boden vorhanden. Der Abbau in Wassertröpfchen wird im Kapitel Abbau in Luft (6) mitbehandelt, der Abbau im Bodenwasser ist Teil von Kapitel 7. Der Bioabbau wird nur soweit betrachtet, als für die Besprechung der Modelle in Teil IV erforderlich. Der Bioabbau in Wasser wird ausführlich bei Schwarzenbach, Gschwend und Imboden [128, 129] behandelt. Die Transformationsprodukte (TP) werden in diesem Zusammenhang Metabolite genannt, weil sie meist den Stoffwechsel (Metabolismus) lebender Organismen zur Voraussetzung haben.
5.1 Hydrolyse
5.1.1 Reaktionskinetik
Die unter dem Überbegriff „Hydrolyse“ zusammengefassten Reaktionen, die nach der allgemeinen Reaktionsgleichung [102] (5.1) ablaufen, sind die typische abiotische Senke im Wasser.
Die Hydrolyse ist an gewisse Strukturelemente – das „X“ in (5.1) – gebunden und tritt daher nicht in allen Substanzklassen auf. Beispiele für hydrolysefähige Verbindungen sind:
- Ester
- Säureamide
- Verbindungen mit reaktionsfähigen Halogenatomen1)
- Epoxide
- Carbamate
Die Hydrolyse führt oft zu einigen wenigen, wohl definierten stabilen Produkten (Transformation, siehe Kapitel 1) und weit seltener zur Mineralisierung. Sie steht damit im Gegensatz zu den meisten anderen abiotischen Senken und ähnelt mehr der biochemischen Transformation, die oft eine enzymatisch katalysierte Hydrolyse darstellt (und damit oft zum gleichen Produkt führt). Die Hydrolyse läuft in der Umwelt meist zuverlässig und berechenbar ab, weil die bestimmenden Umweltrahmenbedingungen Temperatur und pH-Wert2) nur wenig variabel sind im Vergleich zu den entsprechenden Bedingungen Lichtintensität (Photoabbau) und Bakterienpopulationen (Bioabbau). Laborergebnisse sind gut mit Ergebnissen aus Feldversuchen vergleichbar, wenn pH und Temperatur gleich sind.
Kinetisch gesehen ist die Hydrolyse ein vielbenutztes Lehrbuchbeispiel für (pseudomonomolekulare) Reaktionen 1. Ordnung (5.2b), weil die Konzentration des Wassers – Lösungsmittel und Reaktionspartner in einem – praktisch immer konstant ist (55,5 mol/L).
kN, kNII: Reaktionskonstante 1. bzw. 2. Ordnung im pH Neutralbereich
Tatsächlich verlaufen fast alle in der bis heute unübertroffenen Übersichtsarbeit von Mabey und Mill [89] zusammengestellten Reaktionen nach 1. Ordnung.
Bei genauerem Hinsehen besteht die Bruttoreaktion (5.1) aus mehreren Teilreaktionen, die sich kinetisch durch ihre [H+]- und [OH−]-Abhängigkeit unterscheiden. An der Reaktionsordnung ändert das nichts, weil [H+] und [OH−] in natürlichen Gewässern als konstant angesehen werden können und bei der Messung im Labor durch Puffer konstant gehalten werden (OECD TG 111, [102]). Die Puffer-kapazität der natürlichen Gewässer variiert allerdings stark: vom sehr gut auf pH-Werte zwischen 8 und 9 abgepufferten Meereswasser3) bis zu den fast völlig ungepufferten Seen und Bächen auf kristallinem Untergrund. Diese weisen einen pH-Wert auf, der sich durch die Gleichgewichtsverteilung mit dem atmosphärischen CO2 auf ca. pH 5,9 beläuft. Solche ungepufferten Gewässer können auch durch relativ geringe Mengen einer starken Säure oder Base versauert oder alkalisiert werden.
Für die beiden pH-abhängigen Teilreaktionen können Geschwindigkeitskonstanten kA und kB definiert werden, deren Produkte mit [H+] und [OH−] wieder Konstanten 1. Ordnung ergeben, wenn die Bedingung
[H+] = const.
[OH−] = const.
erfüllt ist.
Die erweiterte Differentialgleichung (5.3) für die Reaktionsgeschwindigkeit der Hydrolyse lautet:
In Gleichung 5.3 bedeutet kh die Gesamt-Hydrolysekonstante und kN die Hydrolysekonstante für die Reaktion im Neutralen (ohne Beteiligung von H+ oder OH−); kA und kB sind die Reaktionskonstanten 2. Ordnung für die säure- bzw. basenkatalysierten Teilreaktionen.
In dieser Darstellung (5.3) wird ein Unterschied zwischen Hydrolyse im sauren und im alkalischen Bereich verwischt [26]: H+-Ionen wirken in der Regel nur katalytisch, während OH− z.B. bei der sog. „Verseifung“ von Estern in das Molekül eingebaut und somit verbraucht wird. Man kann Gleichung 5.3 dennoch so wie angegeben schreiben, weil der Unterschied nur mechanistisch relevant ist, aber nichts an der 1. Ordnung der Hydrolyse ändert (da pH = const.); das Produkt kA [H+] bringt nur zum Ausdruck, dass die beobachtete Geschwindigkeitskonstante der Wasserstoffionenkonzentration proportional ist. Das Produkt bedeutet aber nicht, dass H+ verbraucht wird, während bei der alkalischen Esterhydrolyse, der oben genannten Verseifung, eine echte bimolekulare Reaktion vorliegt (5.4):
Das ebenfalls in Lehrbüchern oft benützte Standardbeispiel der Hydrolyse („Inversion“) von Rohrzucker verläuft dagegen H+-katalysiert (5.5):
Für die Berechnung der (hydrolytischen) Lebensdauer von Substanzen in Gewässern hat (5.3) die Konsequenz, dass kh als Funktion des pH-Wertes gemessen werden muss [31, 102].
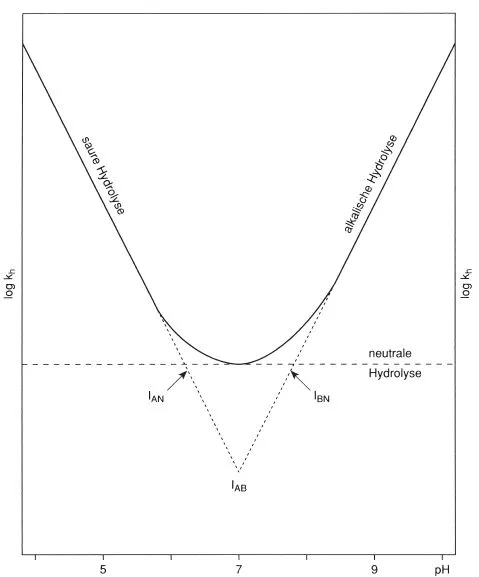
Schematisch kann man die Abhängigkeit der Hydrolysekonstante kh vom pH wie folgt darstellen (Annahme kA = kB) (Abb. 5.1).
Im vereinfachten Beispiel von Abbildung 5.1 dominieren im für Oberflächengewässer relevanten pH-Bereich 4 bis 9 [22] die sauer katalysierte Reaktion (pH 4–5) und die „neutrale“ Reaktion (pH 6–8). Die Verseifung beginnt ab pH 8 an Einfluss zu gewinnen und überwiegt erst ab pH 9.
Interessant sind die Schnittpunkte 1–3 in Abbildung 5.1:
Abb. 5.1 Darstellung der pH-Abhängigkeit der Hydrolyse (schematisch) für den speziellen Fall kA = kB
1) IAN (kA [H+] = kN)
2) IAB (kA [H+] = kB [OH−])
3) IBN (kB [OH−] = kN)
die aus den Hydrolysedaten leicht berechnet werden können. Nicht in jedem Fall sind alle drei Teilreaktionen zu beobachten; besonders die säurekatalysierte Reaktion fehlt häufig. In diesem Fall folgt die Bruttoreaktion im sauren Bereich der Geraden für kN, ist also vom pH-Wert unabhängig.
Neben der pH-Abhängigkeit ist die Temperaturabhängigkeit von größter Bedeutung für die Hydrolysereaktion, um
- Messwerte von höheren Temperaturen (kürzere Versuchsdauer!) auf umweltrelevante Temperaturen umzurechnen, und
- tabellarische Werte (meist für 298 K angegeben [89, 94, 119–122]) auf die in der Regel tiefere Temperatur der Gewässer umzurechnen (Faustregel: bei 298 K ist die Lebensdauer (bzw. Halbwertszeit) etwa halb so hoch wie in einem typischen Gewässer bei gemäßigtem Klima).
Die Temperaturabhängigkeit einer Geschwindigkeitskonstante (k) wird am einfachsten in der Arrheniusauftragung nach (5.6a) dargestellt:
Der präexponentielle Faktor A in (5.6a) ist die auf T = ∞ extrapolierte Geschwindigkeitskonstante [s−1].
| Ea: | Aktivierungsenergie [J/mol] |
| R: | Gaskonstante (8,314 J mol−1 K−1) |
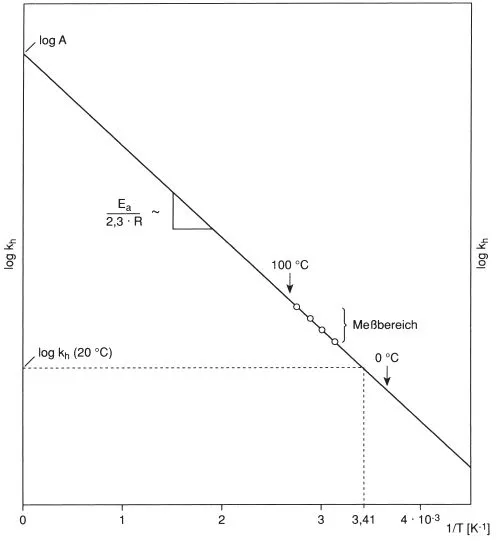
Die logarithmischen Formen (5.6b, 5.6c) eignen sich besonders zur Extrapolation auf tiefere oder höhere Temperaturen (Abb. 5.2). Wenn nur ein bei höherer Temperatur gemessener Wert vorliegt, kann man eine größenordnungsmäßige Abschätzung von kh, (z.B. bei 20 °C), durchführen, indem man eine mittlere Aktivierungsenergie von
zugrunde legt [89]. Liegen mindestens drei bei höheren Temperaturen gemessene Werte von kh vor, kann nach (5.6b) und (5.6c) auf tiefere Temperaturen extrapoliert und die Aktivierungsenergie der Hydrolyse berechnet werden (Abb. 5.2).
Abb. 5.2 Arrheniusauftragung der Reaktionskonstante zur Extrapolation auf tiefere Temperaturen (Hydrolyse)
5.1.2 Messung der Hydrolysegeschwindigkeit
Die experimentelle Bestimmung der Hydrolysegeschwindigkeit als Funktion des pH-Wertes ist in der aktualisierten OECD Prüfrichtlinie [102] genau beschrieben. Sie beruht auf der Lagerung gut definierter wässriger, gepufferter Lösungen der Testsubstanz im Dunkeln und unter kontrollierten Laborbedingungen, bei verschiedenen Temperaturen und analytisch-chemischer Ermittlung der Konzentration als Funktion der Zeit. Vorversuche bei erhöhter Temperatur dienen der Feststellung, ob die Substanz überhaupt hydrolysieren kann, soweit dies nicht schon aus der Struktur ausgeschlossen werden kann. Die Bestimmung von kh ist einfach, wenn:
- die Wasserlöslichkeit Sw >> analytische Nachweisgrenze,
- eine gute Analysenmethode für RX oder ein definiertes Reaktionsprodukt vorhanden ist (am besten UV-VIS-Absorptionsspektroskopie [49, 101, 112] oder HPLC),
- kein schneller Bioabbau (Sterilitätsprobleme) oder Photoabbau in wässriger Lösung (Reaktion im Dunkeln auszuführen) erfolgt,
- die Volatilität aus wässriger Lösung entweder minimal ist oder leicht verhindert werden kann und
- die Reaktion weder sehr schnell noch sehr langsam abläuft.
Die Messung besteht in der Konzentrationsbestimmung der Ausgangssubstanz in wässriger Pufferlösung als Funktion der Zei...