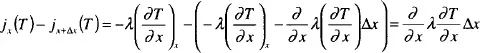![]()
1
Explosionsvorgänge
H. Gg. Wagner
1.1 Einleitung
Die Entwicklung der menschlichen Kultur ist sehr eng verbunden mit dem Gebrauch und der Nutzanwendung des Feuers durch den Menschen [1], Noch heute kommen z. B. über 90% der bereitgestellten Energie aus Verbrennungsprozessen, wobei sich die Zahl der – auch für andere Zwecke – angewandten Verbrennungsverfahren in den letzten Jahrzehnten eher etwas reduziert hat. Bemerkenswert an dieser über Tausende von Generationen gehenden Entwicklung ist das hohe Maß an „Betriebssicherheit“, das der Mensch im Umgang mit Verbrennungsprozessen seit langem zu erreichen und zu halten in der Lage war und ist. Natürlich gibt es keine hundertprozentige Sicherheit, und wir hören gelegentlich von Schadensfeuern oder von Explosionsunglücken, von Verbrennungsprozessen, die außer Kontrolle geraten sind, von Vorgängen, die unerwartet und immer unerwünscht auftreten. Auch wenn deren Anteil am „Gesamtumsatz“ in Verbrennungsprozessen sehr klein ist, so kann doch die lokale Auswirkung verheerend sein. Es ist somit eine wirklich lohnenswerte Aufgabe, dafür zu sorgen, daß solche Ereignisse vermieden werden. Diese Abhandlung soll zur Verhütung von Explosionsunglücken beitragen.
Explosionen können bei der exothermen chemischen Umsetzung eines gasförmigen Brennstoff-Luft-Gemischs entstehen, ebenso können Mischungen aus Staub oder Brennstofftröpfchen mit Luft zu Explosionen führen. Dies sind Gemische, wie sie in technischen Verbrennungsanlagen, in Feuerungen, Brennkammern oder Motoren benutzt werden. Weiter gibt es auch exotherme Verbindungen, die ohne Beisein eines Oxidationsmittels in der Gasphase explodieren können. Als Beispiele seien hier Ozon, Azetylen und Azomethan genannt. Auch andere Oxidationsmittel als Luft, etwa reiner Sauerstoff, Halogene wie Fluor oder Chlor sowie Stickoxide u. a. können, gemischt mit Brennstoff, Anlaß zu sehr heftigen Explosionen sein. Man kann davon ausgehen, daß jeder Stoff oder jede Stoffkombination, die zu (hinreichend) exothermer Reaktion befähigt ist, unter geeigneten Bedingungen auch eine Explosion hervorrufen kann.
Für technische Verbrennungsprozesse bedient man sich zweier verschiedener Arten von Flammen, der vorgemischten Flammen und der Diffusionsflammen. In Brennkammern, in Heizungsbrennern, bei Gas- oder Ölbrennem wird ebenso wie in einer Kerzenflamme mit Diffusionsflammen gearbeitet; Brennstoff und Luft werden getrennt zugeführt. Den Umsatz bestimmt die Mischung beider Komponenten. Der Verbrennungsprozeß läßt sich relativ leicht regeln und stabil halten.
Vorgemischte Flammen sind z. B. vom Bunsenbrenner her bekannt: Brennstoff und Oxidationsmittel treten vorgemischt in die auf dem Brenner bei geeigneter Strömungsgeschwindigkeit des Gemisches stabilisierte Flammenzone ein. Vorgemischte Flammen werden bei Schweißbrennern oder instationär in Gas- und Benzinmotoren verwendet. Es ist unmittelbar einleuchtend, daß eine vorgemischte Flamme schwerer unter Kontrolle zu halten ist als eine Diffusionsflamme. Anders als bei Diffusionsflammen können viele instationäre Prozesse in Verbindung mit der Ausbreitung „vorgemischter Flammen“ bei vorgegebenen Anfangs- und Randbedingungen auftreten.
Damit eine Flamme entstehen kann, muß erfolgreich Entzündung stattgefunden haben. Für die Entzündung eines brennbaren Systems gibt es viele verschiedene Möglichkeiten, die im folgenden aufgeführt werden.
Eine durch erfolgreiche Zündung erzeugte Flamme kann, wie bereits erwähnt, unter entsprechenden Umständen stationär brennen, etwa eine Kerzenflamme oder eine Bunsenbrennerflamme. Unter bestimmten Bedingungen kann sich die Flamme in einem vorliegenden Gemisch räumlich ausbreiten, sie kann bei geeigneten Anfangs- und Randbedingungen in eine Explosion oder eine Detonation übergehen. Die treibende Kraft ist dabei die chemische Reaktion und die durch sie pro Zeit- und Volumeneinheit freigesetzte Energie, die durch geeignete Bedingungen wie Verdämmung, Turbulenz, Strömungshindernisse und viele andere Effekte beeinflußt und erhöht werden kann. Es sind diese Effekte, die in Verbindung mit dem Explosionsschutz besondere Aufmerksamkeit verdienen, besonders immer dann, wenn man den alten Grundsatz des Explosionsschutzes – „Zündquellen unter allen Umständen vermeiden“ – nicht sicher einhalten kann.
Für eine eingehende Behandlung von Verbrennungsvorgängen und für die Darstellung vieler Verbrennungsphänomene, die hier nicht oder nur kurz angesprochen werden können, sei verwiesen auf die regelmäßig erscheinenden Bände des Symposium (International) on Combustion, The Combustion Institute, Pittsburgh und natürlich auf die Unterlagen der der Sicherheitstechnik gewidmeten Tagungen. Weiter gibt es Spezialzeitschriften etwa Combustion and Flame, Combustion Science and Technology, Journal of hazardous Materials u. a., sowie Bücher, die der Verbrennung gewidmet sind, darunter die älteren wie W. Jost, Explosions- und Verbrennungsvorgänge in Gasen [2], W.A. Bone und D.T.A. Townend, Flame and Combustion in Gases [3] und neuere Darstellungen wie B. Lewis und G. von Elbe, Combustion Flames and Explosions in Gases [4], J. Warnatz, U. Maas, R.W. Dibble, Combustion [5], K. Görner, Technische Verbrennungssysteme [6] und andere, die z. T. in der Literaturliste [6] aufgeführt sind, sowie R.M. Fristrom, Flame Structure and Processes [7] und die Bücher von Gaydon [8].
1.1.1 Quantitative Beschreibung von Verbrennungsprozessen
Für die quantitative Beschreibung von Verbrennungsprozessen geht man von den Navier-Stokes-Gleichungen aus. Zusätzlich wird die Wirkung der chemischen Reaktion als Wärmequelle und als Senke bzw. Quelle von Atomen, Molekülen und Radikalen unter Wahrung der Atomerhaltung berücksichtigt. Diese Gleichungen wurden nach Vorarbeiten u. a. von Jouguet von Damköhler aufgestellt [9]; und sie sollen hier kurz in der klassischen Form angegeben und erläutert werden.
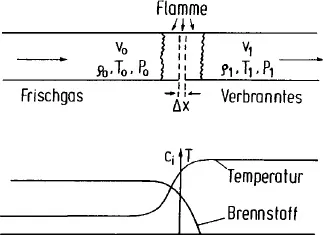
Dazu wollen wir ein stark vereinfachtes eindimensionales System betrachten, in dem eine ebene Flamme in ein von links nach rechts strömendes brennbares Gas läuft (Abb. 1-1).
Dabei sind v0, ρ0, T0, P0 die Strömungsgeschwindigkeit, Dichte, Temperatur und der Druck des unverbrannten Gases v1, ρ1, T1, und P1 die entsprechenden Größen im verbrannten Gas. Wird im Modell v0 so gewählt, daß die Flamme an einem festen Ort bleibt und ist die Strömung laminar, dann entspricht v0 genau der mit Λ0 bezeichneten sog. laminaren Flammengeschwindigkeit, der Geschwindigkeit, mit der sich die Flamme relativ zum Frischgas bewegt und die eine charakteristische Eigenschaft des Gemisches ist. Es gilt dann ρ0v0 = ρ0Λ0 = ρ1v1. Da ρ1 im verbrannten Gas kleiner ist als die Dichte im unverbrannten Gas, bei Kohlenwasserstoff-Luft-Mischungen etwa um den Faktor 6 bis 8, ist v1 entsprechend größer als v0 bzw. Λ0.
Für ein stationäres System, bei dem, wie angenommen, die Flamme an einem festen Ort bleibt, müssen dann die zeitlichen Ableitungen wie ∂T/∂t oder ∂ci/∂t an jeder Stelle gleich 0 sein (ci ist die Konzentration der Komponente i). Die gesamte zeitliche Änderung der Temperatur T (und der Konzentrationen) an einer Stelle setzt sich zusammen aus
- dem Leitungsanteil wie Wärmeleitung (der Wärmestrom ist j = –λ(∂T/∂x), λ = Wärmeleitfähigkeit) bzw. Diffusion j = –D(∂ci/∂x), D = Diffusionskoeffizient
- dem Strömungsanteil – das Ausgangsgemisch ändert in der Reaktionszone seine Geschwindigkeit,
- dem Einfluß der chemischen Reaktion als Quelle für Wärme sowie als Quelle und Senke für Teilchen.
Man kann damit die Gleichungen für T und ci aufstellen, indem man ein Element der Dicke Δx aus der Flamme herausgreift (s. Abb. 1-1) und die Änderung z. B. von T innerhalb dieses Bereichs durch die genannten drei Effekte bestimmt. Für den Einfluß der Wärmeleitung ergibt das z. B.:
Diese Ableitung sei hier nur angedeutet. Für eine genaue Herleitung sei auf di...