
eBook - ePub
Naturgeschichte einer Kerze.
Sechs Vorlesungen für die Jugend.
- 115 Seiten
- German
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
eBook - ePub
Über dieses Buch
= Digitale Neufassung für eBook-Reader =Aus dem Inhalt: ... Die Naturgeschichte einer Kerze wählte ich schon bei einer früheren Gelegenheit zum Thema meines Vortrags, und stände die Wahl nur in meinem Belieben, so möchte ich dieses Thema wohl jedes Jahr zum Ausgang meiner Vorlesungen nehmen, so viel Interessantes, so mannigfache Wege zur Naturbetrachtung im Allgemeinen bietet dasselbe dar. Alle im Universum wirkenden Gesetze treten darin zu Tage oder kommen dabei wenigstens in Betracht und schwerlich möchte sich ein bequemeres Tor zum Eingang in das Studium der Natur finden lassen...
Häufig gestellte Fragen
Ja, du kannst dein Abo jederzeit über den Tab Abo in deinen Kontoeinstellungen auf der Perlego-Website kündigen. Dein Abo bleibt bis zum Ende deines aktuellen Abrechnungszeitraums aktiv. Erfahre, wie du dein Abo kündigen kannst.
Derzeit stehen all unsere auf mobile Endgeräte reagierenden ePub-Bücher zum Download über die App zur Verfügung. Die meisten unserer PDFs stehen ebenfalls zum Download bereit; wir arbeiten daran, auch die übrigen PDFs zum Download anzubieten, bei denen dies aktuell noch nicht möglich ist. Weitere Informationen hier.
Perlego bietet zwei Pläne an: Elementar and Erweitert
- Elementar ist ideal für Lernende und Interessierte, die gerne eine Vielzahl von Themen erkunden. Greife auf die Elementar-Bibliothek mit über 800.000 professionellen Titeln und Bestsellern aus den Bereichen Wirtschaft, Persönlichkeitsentwicklung und Geisteswissenschaften zu. Mit unbegrenzter Lesezeit und Standard-Vorlesefunktion.
- Erweitert: Perfekt für Fortgeschrittene Studenten und Akademiker, die uneingeschränkten Zugriff benötigen. Schalte über 1,4 Mio. Bücher in Hunderten von Fachgebieten frei. Der Erweitert-Plan enthält außerdem fortgeschrittene Funktionen wie Premium Read Aloud und Research Assistant.
Wir sind ein Online-Abodienst für Lehrbücher, bei dem du für weniger als den Preis eines einzelnen Buches pro Monat Zugang zu einer ganzen Online-Bibliothek erhältst. Mit über 1 Million Büchern zu über 1.000 verschiedenen Themen haben wir bestimmt alles, was du brauchst! Weitere Informationen hier.
Achte auf das Symbol zum Vorlesen in deinem nächsten Buch, um zu sehen, ob du es dir auch anhören kannst. Bei diesem Tool wird dir Text laut vorgelesen, wobei der Text beim Vorlesen auch grafisch hervorgehoben wird. Du kannst das Vorlesen jederzeit anhalten, beschleunigen und verlangsamen. Weitere Informationen hier.
Ja! Du kannst die Perlego-App sowohl auf iOS- als auch auf Android-Geräten verwenden, um jederzeit und überall zu lesen – sogar offline. Perfekt für den Weg zur Arbeit oder wenn du unterwegs bist.
Bitte beachte, dass wir keine Geräte unterstützen können, die mit iOS 13 oder Android 7 oder früheren Versionen laufen. Lerne mehr über die Nutzung der App.
Bitte beachte, dass wir keine Geräte unterstützen können, die mit iOS 13 oder Android 7 oder früheren Versionen laufen. Lerne mehr über die Nutzung der App.
Ja, du hast Zugang zu Naturgeschichte einer Kerze. von Michael Faraday, Gerik Chirlek im PDF- und/oder ePub-Format sowie zu anderen beliebten Büchern aus Ciencias físicas & Química física y teórica. Aus unserem Katalog stehen dir über 1 Million Bücher zur Verfügung.
Information
Fünfte Vorlesung.
Wir haben gesehen: beim Verbrennen einer Kerze gewinnen wir Wasser, und aus diesem Wasser können
wir Wasserstoff und Sauerstoff darstellen. Der Wasserstoff, wisst Ihr, stammt von der Kerze her, und der Sauerstoff, glaubt Ihr, tritt aus der Luft hinzu. Da könntet Ihr nun mit Recht fragen: „Wie kommt‘s denn aber, dass die Kerze nicht gleich gut in Luft und in Sauerstoff brennt?“ Ihr erinnert Euch recht gut, wie ich ein brennendes Stückchen Licht in Sauerstoff brachte (vergl. Fig. 22), dass da die Verbrennung eine ganz andere, nämlich viel lebhafter war, als an der atmosphärischen Luft. Nun, warum das? Diese Frage ist von der höchsten Wichtigkeit für uns; sie berührt ganz unmittelbar die Natur der atmosphärischen Luft, und ich werde mich bemühen, sie Euch verständlich zu beantworten.
Ihr habt gesehen, wie eine Kerze an der Luft und wie sie in Sauerstoff brennt; Ihr habt dasselbe beobachtet beim Phosphor und ebenso bei Eisenfeilspänen. Es gibt indes noch verschiedene andere Beispiele für dieselbe Erscheinung, und um Eure Erfahrung und Eure Einsicht zu bereichern, werde ich Euch noch etliche vorführen. Hier habe ich ein Gefäß voll Sauerstoff; dass solcher darin ist, muss ich Euch freilich erst nachweisen: ich bringe einen schwach glimmenden Span hinein, und die Erfahrungen, die Ihr das vorige Mal gesammelt habt, lassen Euch den Erfolg mit Bestimmtheit voraussagen – seht her: durch diese lebhafte Verbrennung ist die Anwesenheit des Sauerstoffs unzweifelhaft nachgewiesen. Und nun eine andere und zwar sehr merkwürdige und nützliche Probe auf Sauerstoff. Da habe ich zwei Gefäße; beide sind mit Gasen gefüllt, und zwischen ihnen steht eine Platte, damit die Gase sich nicht berühren können. Die Platte nehme ich jetzt weg, und die beiden Gase kriechen nun förmlich in einander hinein. „Was geschieht denn da?“ fragt Ihr; „es findet ja keine Verbrennung statt, wie wir‘s bei der Kerze gesehen haben!“ Und dennoch sollt Ihr in dieser Verbindung des einen Gases mit dem anderen einen Beweis für die Gegenwart von Sauerstoff kennenlernen. Seht das schön rot gefärbte Gas, das auf diese Weise entstanden ist! Wir können das Experiment in derselben Weise auch mit gewöhnlicher Luft machen, wenn wir sie mit diesem Prüf-Gas mischen. In diesem Gefäß hier ist bloß Luft und in dieser Flasche unser Prüf-Gas; ich gehe mit beiden über das Wasserbecken hier, bringe sie jetzt dicht aneinander, und nun seht das Ergebnis: der Inhalt der einen fließt vollständig in die andere über, die nur Luft enthielt; wir beobachten genau denselben Vorgang wie vorhin beim Sauerstoff und schließen daraus wiederum, dass der Sauerstoff auch in der Luft vorhanden ist – ganz derselbe Sauerstoff, den wir schon aus dem von der Kerze entwickelten Wasser darstellten. Aber warum brennt denn nun die Kerze in der Luft doch nicht so gut wie in Sauerstoff? Nun, wir werden sogleich auf diesen Punkt kommen. Hier habe ich zwei Gläser; beide sind bis zu derselben Höhe mit Luftarten gefüllt, die ganz gleiches Aussehen haben, und in der Tat weiß ich augenblicklich nicht, welches von beiden Gefäßen Sauerstoff und welches atmosphärische Luft enthält – nur, dass sie mit diesen sorgsam gefüllt wurden, weiß ich bestimmt. Indes, da habe ich ja unser Prüf-Gas von vorhin; das will ich auf beide Gefäße einwirken lassen, um zu sehen, ob sich an dem Rotwerden dieses Gases in den beiden anderen Gasen eine Verschiedenheit zeigt. Ich lasse das Gas also in eins der Gläser einfließen und sehe zu, was sich ereignet. Da seht, es wird sofort rot – also ist Sauerstoff darin! Nehmen wir nun das andere Gefäß vor. Ihr seht, das wird nicht so rasch und nicht so entschieden rot als das erste. Dabei zeigt sich aber noch folgender merkwürdige Umstand: Wenn ich diese beiden Gase mit Wasser gut durchschüttle, so nimmt das Wasser das rote Gas in sich auf, löst es, und wenn ich dann von neuem etwas Prüf-Gas hineinlasse, sodass abermals rotes Gas entsteht, und schüttle wieder, so wird es ebenfalls absorbiert, und das kann ich so lange fortsetzen, als noch eine Spur Sauerstoff in dem Gefäß vorhanden ist. Wenn ich Luft hineinlasse, geschieht nichts dergleichen; aber in dem Augenblick, wo ich Wasser hineinbringe, verschwindet das rote Gas, und ich kann so fort und fort von unserem Prüf-Gas mehr hinzufügen, bis ich zu einem Punkt komme, wodurch diesen eigentümlichen Körper, der die Luft und den Sauerstoff rot färbt, keine Rötung mehr hervorgerufen wird. Woher kommt das? Ihr seht es im Augenblick: weil außer dem Sauerstoff noch etwas Anderes vorhanden, also von der Luft übriggeblieben ist. Ich will noch ein wenig Luft in das Gefäß einlassen; und wenn wieder eine Rötung erfolgt, so könnt Ihr daraus schließen, dass von dem rotfärbenden Gas noch etwas darin war, dass also auch nicht der Mangel desselben das Zurückbleiben jener Luftart bedingte.
Nunmehr werdet Ihr leichter im Stande sein, das zu verstehen, was ich eigentlich zu sagen hatte. Als ich Phosphor in einem Gefäß verbrannte (siehe Fig. 9), saht Ihr, dass nach der Verdichtung der aus Phosphor und dem Sauerstoff der Luft gebildeten Dämpfe noch etwas aus der Luft in ziemlicher Menge unverbraucht übrig geblieben war – ganz so, wie hier das rote Gas etwas unberührt zurücklässt, und wirklich ist es ein und dasselbe Gas, welchem dort der Phosphor wie hier das rotfärbende Gas nichts anhaben konnte, und dieses Etwas ist eben kein Sauerstoff, aber doch ein Bestandteil der atmosphärischen Luft.
Da haben wir also ein Mittel gefunden, die Luft in die beiden Stoffe zu zerlegen, aus denen sie zusammengesetzt ist – in Sauerstoff, der die Kerze, den Phosphor und alles andere verbrennen macht, und in den anderen Körper, der keine Verbrennung zulässt, den Stickstoff, Nitrogen. Dieser andere Bestandteil ist in sehr überwiegender Menge in der Luft enthalten. Bei seiner Prüfung werden wir ganz sonderbare Eigenschaften an ihm entdecken; es ist ein ganz merkwürdiger Körper, obwohl er Euch vielleicht ganz uninteressant vorkommt. In mancher Hinsicht mag er dies freilich scheinen, z. B. darin, dass er keine so brillanten Verbrennungen hervorbringt wie der Sauerstoff. Wie den Wasserstoff und den Sauerstoff, will ich auch ihn zunächst mit meinem Wachslicht prüfen. Da seht, er entzündet sich nicht, wie es der Wasserstoff tat, und er lässt den Wachsstock nicht fortbrennen, wie wir‘s beim Sauerstoff sahen; ich mag‘s anstellen, wie ich nur will, er tut weder dies noch jenes; er selbst fängt nicht Feuer, und den brennenden Wachsstock verlöscht er gar; jede Flamme löscht er aus, mag brennen, was da will; es gibt nicht einen Körper, der unter gewöhnlichen Umständen darin zu brennen im Stande ist. Der Stickstoff riecht nicht, er schmeckt nicht, er löst sich nicht in Wasser, er ist weder sauer noch alkalisch, er ist so völlig indifferent gegen alle unsere Sinne, wie es nur irgendetwas sein kann. Da möchtet Ihr vielleicht sagen: „Mit dem ist nichts – der ist unsrer Aufmerksamkeit gar nicht wert – was tut denn der in der Luft?“ Doch halt! Lasst uns nur etwas genauer zusehen, ob wir an ihm nicht ganz wichtige und hübsche Beobachtungen machen können. Nehmen wir einmal an, die Luft bestände aus lauter Sauerstoff, statt aus einer Mischung von Stickstoff mit Sauerstoff – was würde da aus uns werden? Ihr wisst recht gut, dass ein glühendes Stück Eisen in einem Gefäß mit reinem Sauerstoff vollständig verbrennt; nun seht das eiserne Rost auf dem Herd im Feuer – wo würde es bleiben, wenn die Luft nur aus Sauerstoff bestände! Der Rost würde eher verbrennen als die Kohlen; denn das Eisen des Rostes hat mehr Neigung zum Verbrennen, d. h. es hat mehr Verwandtschaft zum Sauerstoff als die Kohle auf ihm. Das Feuer in einer Lokomotive würde ein Feuer mitten in einem Holzmagazin sein, wenn die atmosphärische Luft aus lauter Sauerstoff bestände. Der Stickstoff aber bändigt das Feuer, macht es uns dienstbar, und außerdem nimmt er die anderen Verbrennungsprodukte mit sich fort, wie Ihr sie auch bei der Kerze habt aufsteigen sehen, zerstreut sie in der weiten Atmosphäre und leitet sie wieder an Stellen hin, wo sie zur Entwicklung eines anderen, für den Menschen wichtigen Vorganges sehr nötig gebraucht werden, zur Unterhaltung nämlich aller Vegetation. Und so seht Ihr, dass dieser Körper, den Ihr anfänglich für so uninteressant hieltet, uns ganz wunderbare Dienste leistet.
Der Stickstoff ist in seinem gewöhnlichen Zustand ein völlig indifferentes Element; auch der stärkste elektrische Strom veranlasst ihn nicht, eine direkte Verbindung mit dem anderen Bestandteil der Luft, mit dem Sauerstoff, oder mit irgendeinem anderen Körper einzugehen; er ist ganz und gar indifferent, und ich möchte ihn deshalb einen zuverlässigen Körper nennen.
Bevor wir indes näher auf seine Eigenschaften eingehen, muss ich erst von der atmosphärischen Luft selbst noch einiges sagen. Ich will hier die Zusammensetzung von 100 Teilen Luft anschreiben:
Raumteile.
Sauerstoff . . . . . 20
Stickstoff . . . . . . 80
--------------------------
100
Gewichtsteile.
Sauerstoff . . . . . 22.3
Stickstoff . . . . . . 77.7
----------------------------
100.0
Das ist genau das Verhältnis des Sauerstoffs und des Stickstoffs in der atmosphärischen Luft, wie es uns die Analyse ergibt; wir finden 4 Volumen Stickstoff neben 1 Volumen Sauerstoff; eine so überwiegende Menge Stickstoff ist also erforderlich, um den Sauerstoff so weit niederzuhalten, dass unsere Kerze ordentlich brennt, und die Luft in einen solchen Zustand zu versetzen, dass unsere Lungen sicher und gesund darin atmen können; denn beides, unser Atmen sowohl wie das Brennen der Kerze oder der Feuerung im Ofen hängt gleichmäßig von diesem richtigen Mischungsverhältnis des Sauerstoffs und des Stickstoffs in der Luft ab.
Das Gewichtsverhältnis ist folgendes:
1 Kubikfuß Stickstoff – wiegt 1 1/6 Unze.
1 Kubikfuß Sauerstoff – wiegt 1 3/4 Unze.
1 Kubikfuß atmosphärische Luft – wiegt 1 1/5 Unze.
Ich habe schon öfters die Frage von Euch gehört und mich darüber wirklich gefreut: „Wie wiegt man denn Gase?“ Ich will‘s Euch zeigen. Es ist ganz einfach und leicht. Hier habe ich eine Waage und hier eine kupferne Flasche; diese ist so dünn und leicht als möglich gemacht, doch so, dass sie noch ganz fest und luftdicht ist, wie sich‘s auf der Drechselbank recht hübsch ausführen lässt; sie ist mit einem Hahn versehen, den man leicht schließen und öffnen kann; jetzt aber steht er offen, lässt also die Luft frei in die Flasche eintreten.

Fig. 25
Hier nun habe ich meine feine, sehr empfindliche Waage, und ich glaube, die Flasche in ihrem gegenwärtigen Zustande wird gerade von dem Gewicht gehalten werden, das auf der anderen Schale liegt. Ferner habe ich hier eine Pumpe, mittelst welcher wir Luft in die kupferne Flasche pressen können, und zwar eine gewisse Anzahl solcher Volumen Luft, denen der Stiefel der Pumpe als Maß dient. Wir wollen jetzt gleich zwanzig solche Volumen in die Flasche hineinpumpen. – So! – Nun schließen wir den Hahn fest und bringen die Flasche auf die Waage. Seht, wie sie sinkt! Sie ist jetzt bedeutend schwerer geworden. Warum? Nun, zufolge der Luft, die wir mit der Pumpe hineingezwängt haben. Es ist nichts als Luft darin, die Luft darin nimmt auch keinen größeren Umfang ein, aber wir haben schwerere Luft in demselben Umfang, weil wir eben die Luft zusammengepresst haben. Damit Ihr nun gleich ganz genau erfahrt, wie schwer diese Luft ist, habe ich hier eine Flasche voll Wasser, deren Hals genau in den der Kupferflasche passt und ebenfalls mit einem Hahn versehen ist. Ich schraube sie beide sorgfältig aufeinander und öffne die Hähne, sodass nun die aus 20 Pumpenzügen komprimierte Luft in die Glasflasche übertreten und sich ungehindert zu ihrem ursprünglichen Umfang wieder ausdehnen kann. Um nun unserer Sache sicher zu sein, dass wir bei unsrer Arbeit ganz richtig zu Werke gegangen sind, wollen wir die kupferne Flasche wieder auf die Waage legen; wird sie von dem Gewicht auf der anderen Schale – es ist noch dasselbe wie vorhin – auch jetzt wieder genau gehalten, so war unser Experiment richtig. Seht, die Waage steht ganz gleich.

Fig. 26
Auf diese Weise also können wir das Gewicht der Luftmenge ermitteln, die wir mittelst der Pumpe hineinpressen und daraus dann das Gewicht eines Kubikfußes Luft auf 1 1/5 Unze bestimmen. Doch kann solch kleines Experiment Euch unmöglich die ganze Bedeutung dieses Gegenstandes vor Augen führen. Es ist wahrhaft wunderbar, wie viel auffälliger sie wird, wenn man solche Versuche mit größeren Luftmengen ausführt. Dieses Volumen Luft hier – das ist 1 Kubikfuß – wiegt also 1 1/5 Unze. Wie hoch schätzt Ihr den Inhalt des Kastens dort, den ich eigens zu diesem Zweck habe machen lassen? Die Luft darin wiegt gerade 1 Pfund, ein volles Pfund. Auch das Gewicht der Luft in diesem Zimmer habe ich genau berechnet; sie wiegt – Ihr werdet‘s kaum denken – aber sie wiegt wirklich über eine Tonne. Seht, so ungeheuer wachsen da gleich die Zahlen an, und von solcher Bedeutung ist die Gegenwart der atmosphärischen Luft und des Sauerstoffs und Stickstoffs in ihr, woraus wir wiederum auf die Größe des Nutzens schließen können, den sie uns schafft, indem sie Stoffe hin und her, von einem Ort zum anderen versetzt und schädliche Dünste dahin bringt, wo sie nützlich wirken statt zu schaden.
Da ich Euch nun dieses kleine Experiment gezeigt habe, wollen wir auch gleich einige Folgerungen daraus ziehen, ohne welche Ihr so manches andre, zu dem wir noch gelangen werden, nicht recht verstehen würdet. Erinnert Ihr Euch vielleicht eines ähnlichen Experimentes? Habt Ihr noch nichts dergleichen beobachtet? Nun will ich einmal eine ähnliche Pumpe nehmen, wie ich sie vorhin benutzte, um Luft in die kupferne Flasche hineinzupressen, und will den Apparat so einrichten, dass ich die Öffnung mit der Hand bedecken kann. Wir können die Hand in freier Luft so leicht hin und her bewegen und glauben kaum etwas dabei zu fühlen; es erfordert schon eine sehr rasche Bewegung, um einen Widerstand der Luft gewahr zu werden. Wenn ich aber meine Hand hier auf den Rezeptor der Luftpumpe decke und lasse nun die Luft auspumpen – seht da, was geschieht!
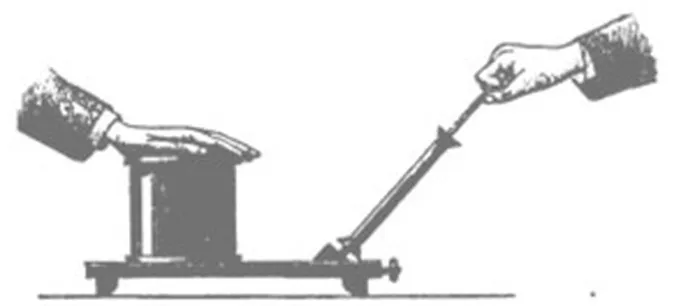
Fig. 27
Wieso ist meine Hand auf einmal an den Apparat gefesselt, sodass ich die ganze Luftpumpe mit herumziehen kann, da ich sie doch gar nicht anfasse und halte? Seht, ich kann die Hand kaum wieder davon losmachen. Nun, was ist die Ursache? Der Luftdruck. Das Gewicht der darüber befindlichen Luft drückt meine Hand so fest auf den leeren Raum darunter.
Ich habe da noch ein anderes Experiment vor, das Euch darüber noch bessere Aufklärung geben wird. Über diese Glasglocke ist eine Schweinsblase ausgespannt und festgebunden; ich bringe die Glocke auf die Luftpumpe und pumpe die Luft heraus – Ihr werdet gleich den Erfolg sehen; jetzt ist die Blase flach ausgespannt; setze ich aber die Pumpe ein wenig in Bewegung – seht, wie sie einsinkt, wie sie nach unten eingedrückt wird; seht, wie sie tiefer und immer tiefer niederwärts geht, bis sie vermutlich zuletzt durch die Gewalt der darauf drückenden Luft zersprengt werden wird. [Die Blase zerspringt zuletzt mit einem lauten Knall.] Das geschah einzig und allein durch die darauf drückende Last der darüberstehenden Luft, und dies...
Inhaltsverzeichnis
- Naturgeschichte einer Kerze.
- Technische Anmerkungen
- Erste Vorlesung.
- Zweite Vorlesung.
- Dritte Vorlesung.
- Vierte Vorlesung.
- Fünfte Vorlesung.
- Sechste Vorlesung.
- Digitale Neufassungen
- Impressum