
- 208 Seiten
- German
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
eBook - ePub
Über dieses Buch
Ein spannender Reiseführer durch den faszinierenden Kosmos der Synthesen.Ist die Chemie besser als ihr Ruf? Sie ist die Schlüsseldisziplin, wenn es um die Lösung der großen Herausforderungen der Menschheit geht. In diesem Buch unternehmen der preisgekrönte Chemiker Nuno Maulide und die Physikerin Tanja Traxler eine packende Reise in die faszinierende Welt der Synthesen, Bindungen und Reaktionen. Unterhaltsam und lebensnah schildern die Autoren, wie Chemie unseren Alltag beeinflusst. Sie diskutieren chemische Lösungsansätze für globale Probleme wie Klimawandel, Ernährungssicherheit der wachsenden Weltbevölkerung und Müllproduktion. Denn was ist Chemie eigentlich? Es ist die Wissenschaft von uns selbst, der Natur und dem ganzen Universum.
Häufig gestellte Fragen
Ja, du kannst dein Abo jederzeit über den Tab Abo in deinen Kontoeinstellungen auf der Perlego-Website kündigen. Dein Abo bleibt bis zum Ende deines aktuellen Abrechnungszeitraums aktiv. Erfahre, wie du dein Abo kündigen kannst.
Nein, Bücher können nicht als externe Dateien, z. B. PDFs, zur Verwendung außerhalb von Perlego heruntergeladen werden. Du kannst jedoch Bücher in der Perlego-App herunterladen, um sie offline auf deinem Smartphone oder Tablet zu lesen. Weitere Informationen hier.
Perlego bietet zwei Abopläne an: Elementar und Erweitert
- Elementar ist ideal für Lernende und Profis, die sich mit einer Vielzahl von Themen beschäftigen möchten. Erhalte Zugang zur Basic-Bibliothek mit über 800.000 vertrauenswürdigen Titeln und Bestsellern in den Bereichen Wirtschaft, persönliche Weiterentwicklung und Geisteswissenschaften. Enthält unbegrenzte Lesezeit und die Standardstimme für die Funktion „Vorlesen“.
- Pro: Perfekt für fortgeschrittene Lernende und Forscher, die einen vollständigen, uneingeschränkten Zugang benötigen. Schalte über 1,4 Millionen Bücher zu Hunderten von Themen frei, darunter akademische und hochspezialisierte Titel. Das Pro-Abo umfasst auch erweiterte Funktionen wie Premium-Vorlesen und den Recherche-Assistenten.
Wir sind ein Online-Abodienst für Lehrbücher, bei dem du für weniger als den Preis eines einzelnen Buches pro Monat Zugang zu einer ganzen Online-Bibliothek erhältst. Mit über 1 Million Büchern zu über 1.000 verschiedenen Themen haben wir bestimmt alles, was du brauchst! Weitere Informationen hier.
Achte auf das Symbol zum Vorlesen bei deinem nächsten Buch, um zu sehen, ob du es dir auch anhören kannst. Bei diesem Tool wird dir Text laut vorgelesen, wobei der Text beim Vorlesen auch grafisch hervorgehoben wird. Du kannst das Vorlesen jederzeit anhalten, beschleunigen und verlangsamen. Weitere Informationen hier.
Ja! Du kannst die Perlego-App sowohl auf iOS- als auch auf Android-Geräten nutzen, damit du jederzeit und überall lesen kannst – sogar offline. Perfekt für den Weg zur Arbeit oder wenn du unterwegs bist.
Bitte beachte, dass wir Geräte, auf denen die Betriebssysteme iOS 13 und Android 7 oder noch ältere Versionen ausgeführt werden, nicht unterstützen können. Mehr über die Verwendung der App erfahren.
Bitte beachte, dass wir Geräte, auf denen die Betriebssysteme iOS 13 und Android 7 oder noch ältere Versionen ausgeführt werden, nicht unterstützen können. Mehr über die Verwendung der App erfahren.
Ja, du hast Zugang zu Die Chemie stimmt! von Nuno Maulide,Tanja Traxler im PDF- und/oder ePub-Format sowie zu anderen beliebten Büchern aus Naturwissenschaften & Chemie. Aus unserem Katalog stehen dir über 1 Million Bücher zur Verfügung.
Information
Thema
NaturwissenschaftenThema
Chemie
WIR FÜRCHTEN UNS VOR DEM FALSCHEN
Beginnen wir mit der weitverbreiteten Furcht vor Chemikalien im Essen. »Das ist ja reine Chemie!«, denken viele Menschen, wenn sie die Inhaltsangaben diverser Lebensmittel lesen. Das stimmt natürlich – trifft aber auf die Himbeeren aus Omas Garten genauso zu wie auf die Tiefkühlpizza aus dem Supermarkt. Dass Tiefkühlpizza aber definitiv ungesünder ist als Himbeeren, liegt nicht daran, dass in der Pizza künstlich erzeugte Chemikalien zu finden sind und im Obst rein natürlich entstandene. Es liegt nur an der Menge und Art der jeweiligen Inhaltsstoffe. Daher ist es wichtig, zu unterscheiden, was in welcher Menge schädlich ist oder die Qualität eines Produkts beeinflussen kann.
Es ist das eine, auf akute Gefahren wie Vergiftungen rasch zu reagieren. Etwas gänzlich anderes und mit Blick auf die Ernährung häufig Relevanteres ist es aber, langfristige Risiken angemessen einzuschätzen. Wenn es um mögliche Gefahren geht, die mit einer gewissen Wahrscheinlichkeit in Jahren oder Jahrzehnten eintreten könnten, neigen wir bisweilen dazu, uns vor dem Falschen zu fürchten. Der Risikoforscher Ortwin Renn hat dafür den Begriff »Risikoparadox« geprägt.1
Eine unserer irrationalen Ängste betrifft beispielsweise, Opfer eines Terroranschlags zu werden. Obwohl die Wahrscheinlichkeit dafür für Menschen, die in westlichen Industrienationen leben, äußerst gering ist, treibt uns die Angst davor mitunter zu Entscheidungen, die wirklich mit erhöhten Risiken verbunden sind. Eine Studie, die in diesem Kontext gerne angeführt wird, betrifft die Terroranschläge in New York vom 11. September 2001. Aus Angst vor einer Flugzeugentführung sind in den darauffolgenden Monaten viele US-Passagiere mit dem Auto statt mit dem Flugzeug gereist. Die Folge war ein signifikanter Anstieg des Autoverkehrs – und auch der tödlichen Unfälle auf US-Straßen. Insgesamt gab es in den drei Monaten nach den Anschlägen mehr Unfalltote, bedingt durch Autofahrer, die das Flugrisiko vermeiden wollten, als Opfer der Terroranschläge vom 11. September 2001.2
Was die Ernährung angeht, ist unsere Furcht vor dem Falschen besonders ausgeprägt. Viele Menschen betrachten beispielsweise argwöhnisch künstlich erzeugte Aromastoffe, die auf der Rückseite von Lebensmittelverpackungen angeführt sind, und versuchen, diese tunlichst zu vermeiden – auch wenn sie keine nachweislichen Gesundheitsrisiken darstellen. Andererseits scheuen sie nicht davor zurück, Substanzen, die bekanntermaßen schädlich sein können, wie Alkohol, Transfette oder Zucker, üppig zu konsumieren.
Um zu ergründen, mit welchen Chemikalien wir es bei unserem Essen zu tun haben, bedarf es zunächst einer kleinen Einführung in die Welt der chemischen Bausteine. Los geht’s!
DER CHEMISCHE AUFBAU DER WELT
Wenn man die Welt durch die Brille der Chemie betrachtet, wird sichtbar, dass im Grunde alles um uns aus denselben Bausteinen besteht – den Atomen. Die Idee, dass alles aus Atomen gemacht ist, geht bis in die Antike zurück. Doch noch Anfang des 20. Jahrhunderts stritten sich Wissenschaftler darüber, ob Atome tatsächlich existieren.
Legendär sind beispielsweise die Auseinandersetzungen zwischen dem österreichischen Physiker Ludwig Boltzmann, der ein vehementer Fürsprecher des Atomismus war, und seinem Vorgänger am Wiener Lehrstuhl für Naturphilosophie, Ernst Mach. Mach pflegte Boltzmanns Überzeugung, dass Atome existieren, süffisant mit der Bemerkung »Ham’s ans g’sehen?« in breitem Wienerisch abzutun. Einen wichtigen Beitrag zur Lösung des Streits leistete schließlich 1905 ein junger Angestellter des Berner Patentamts und noch weitgehend unbekannter Physiker: Albert Einstein. Er konnte die durch Mikroskopbeobachtungen bekannte sogenannte Brownsche Bewegung von kleinen Körnchen durch zufällige Stöße von Atomen oder Molekülen erklären. Damit war eine eindrucksvolle Lanze für den Atomismus gebrochen, den bald auch die Zweifler akzeptieren mussten. Inzwischen können wir Atome mit speziellen Mikroskopen detailliert beobachten.

Die altgriechische Wurzel des Worts Atom ist átomos, was unteilbar bedeutet. Mittlerweile ist allerdings klar, dass Atome aus noch kleineren Teilchen bestehen. Im Kern der Atome ist die Masse konzentriert. Er besteht aus elektrisch positiv geladenen Protonen und neutralen Neutronen, die ihrerseits aus noch kleineren Teilchen zusammengesetzt sind – den Quarks. Der Atomkern wird umgeben von negativ geladenen Elektronen.
Je nachdem, wie viele Protonen ein Atom hat, handelt es sich dabei um ein bestimmtes Element. Ungeladene Atome besitzen gleich viele Protonen wie Elektronen. Gibt es einen Überschuss oder Mangel an Elektronen, hat man es mit geladenen Atomen zu tun – sie werden Ionen genannt. Atome des Elements Wasserstoff bestehen beispielsweise aus einem Proton, einem Elektron und keinem Neutron. Heliumatome wiederum setzen sich aus zwei Protonen, zwei Neutronen und zwei Elektronen zusammen. Das Element mit der größten Anzahl an Protonen ist nach derzeitigem Stand Oganesson – es besitzt gar 118 Protonen, 176 Neutronen und 118 Elektronen. Sollte man Oganesson also unbedingt als Rekordhalter im Langzeitgedächtnis abspeichern? Nicht unbedingt, denn es ist wohl nur eine Frage der Zeit, bis ein Element entdeckt wird, dessen Atome noch mehr Protonen aufweisen.

Schon im antiken Griechenland haben sich die Menschen Gedanken darüber gemacht, aus welchen Elementen oder Essenzen alles in der Welt besteht. Eine beliebte Vorstellung war damals, dass es vier Grundelemente gibt: Erde, Wasser, Luft und Feuer. Etliche griechische Denker stellten sich vor, dass alles Seiende aus einer Mischung dieser vier Elemente besteht – diese Ansicht kommt beispielsweise in den philosophischen Dialogen von Platon zum Ausdruck.
Ein anderes Thema, mit dem sich Platon intensiv in seinen Schriften beschäftigte, hat auf den ersten Blick wenig mit Chemie zu tun: Im Dialog Symposion unterhalten sich die griechischen Gelehrten und Schriftsteller ausführlich über Liebe und Erotik. Aristophanes erinnert die Runde daran, dass Eros die Kraft sei, die dem Menschen zum größten Glück verhilft. Ursprünglich seien die Menschen von titanischer Natur gewesen – kugelförmig, doppelköpfig, androgyn oder von zweifacher gleicher Geschlechtlichkeit. Doch wegen ihres Versuchs, sich mit den Göttern anzulegen, seien sie von Zeus gespalten worden.3 Seitdem sehne sich jeder nach seiner verlorenen Hälfte. »Jeder von uns ist daher nur ein Teilstück eines Menschen«, wird Aristophanes von Platon zitiert, »da wir ja, zerschnitten wie die Schollen, aus einem zwei geworden sind. Jeder sucht demnach beständig sein Gegenstück.«4 Liebe ist demzufolge immer Liebe zu etwas, sie bedarf also dessen, wonach sie sich sehnt.5
Man könnte sagen, dass Platon damit ein Grundprinzip allen menschlichen Strebens getroffen hat. Zugleich ist aber nicht von der Hand zu weisen, dass es in gewisser Hinsicht auch in der Chemie immer nur um das eine geht: Es dauerte beinahe 2000 Jahre, bis sich die Menschen von der Vier-Elemente-Lehre verabschiedet hatten und schließlich zur heutigen Vorstellung von Elementen fanden. Dafür gibt es einen offensichtlichen Grund: Wie wir heute wissen, kommen die Elemente selten in Reinform vor. In den allermeisten Fällen verbinden sie sich mit anderen Elementen. Sie gehen sozusagen Beziehungen ein, zu zweit, zu dritt oder zu Tausenden. Manche sind einander lange treu, andere bevorzugen Abwechslung. Sobald sich ein Gespann von Atomen eines oder mehrerer Elemente gefunden hat, spricht man von einem Molekül.
Moleküle können also aus Atomen eines einzigen Elements bestehen. Ein prominentes Beispiel dafür ist der für uns lebensnotwendige molekulare Sauerstoff O2 – er setzt sich (richtig geraten!) aus zwei Sauerstoffatomen zusammen, die jeweils mit dem Buchstaben O abgekürzt werden. Doch das ist eher selten, in der Regel finden sich Atome unterschiedlicher Elemente zusammen. Und um zu Platons Symposion zurückzukehren, könnte man sagen, dass sie dabei ein bestimmtes Begehren verfolgen. Das Bedürfnis, Bindungen einzugehen, hängt maßgeblich von ihren negativ geladenen Teilchen ab: den Elektronen. Sehr vereinfacht kann man sich vorstellen, dass die Elektronen den Atomkern in verschiedenen Abständen wie die Schalen einer Zwiebel umgeben. In der ersten Schale haben zwei Elektronen Platz, in jeder weiteren acht.
Es ist wichtig zu betonen, dass das Schalenmodell nur eine anschauliche Art ist, das Atom zu beschreiben. Auch wir Wissenschaftler kennen die letzte Wahrheit nicht. Wir können aber versuchen, Modelle aufzustellen, die unsere experimentellen Befunde möglichst gut beschreiben. Es gibt auch komplexere Modelle als das Schalenmodell, die noch näher an die Wirklichkeit heranreichen. Aber zur anschaulichen Erklärung taugt die Zwiebel allemal.
Um zu verstehen, warum Atome Bindungen eingehen, muss man wissen, dass alle Atome einen Tick haben: Sie wollen unbedingt ihre äußerste Schale mit Elektronen auffüllen. Damit das gelingt, schließen sie sich zu Molekülen zusammen und teilen sich gewissermaßen ihre äußersten Elektronen. Ein Beispiel: Bei Wassermolekülen H2O teilt sich das Sauerstoff atom je ein Elektron mit den beiden Wasserstoffatomen – Letztere werden mit H abgekürzt. Wenn jeder Partner ein Elektron einbringt, spricht man von Einfachbindung. Durch diese zwei Einfachbindungen können sowohl die Wasserstoffatome wie auch das Sauerstoffatom ihre Bedürfnisse nach Elektronen befriedigen. Ein anderes Beispiel ist der molekulare Sauerstoff O2. Hier trägt jedes der beteiligten Sauerstoffatome zwei Elektronen bei – in so einem Fall spricht man von einer Doppelbindung oder Zweifachbindung, die im Allgemeinen stärker als die vergleichbare Einfachbindung ist. Bei einer Dreifachbindung sind gar drei Elektronenpaare beteiligt, was sie stärker als die anderen Bindungen macht – mehr dazu später.
In der Chemie befassen wir uns selten mit den Elementen in ihrer reinen Form. Im Wesentlichen geht es uns um Reaktionen und die Verbindungen, die Atome mit einander eingehen. So manch einer würde daher so weit gehen zu behaupten, dass man die halbe Chemie in einem Satz, wie folgt, zusammenfassen kann: »Atome, denen auf ihrer äußeren Ebene Elektronen fehlen, werden tauschen, betteln, kämpfen, Bündnisse schmieden oder brechen und alles Erdenkliche tun, was nötig ist, um auf die richtige Anzahl zu kommen.«6 Und genau dieser Tauschhandel und Machtkampf der Elektronen findet tagtäglich in unserem Körper statt, wenn uns nach bestimmten Nahrungsmitteln gelüstet oder wir sie im Stoffwechsel verarbeiten. Okay, wahrscheinlich spielen auch noch ein paar andere Faktoren eine Rolle, aber immerhin eröffnet der chemische Blick auf unsere Teller einige erhellende Einsichten. Ich hoffe, Sie haben jetzt Appetit bekommen, mehr darüber zu erfahren.
TAUSENDE CHEMIKALIEN IM ESSEN
Ein zentraler Bestandteil unseres Essens sind Kohlenhydrate. Chemisch gesehen, sind Kohlenhydrate Substanzen, die aus ein oder mehreren Zuckermolekülen bestehen. Die einfachste Form von Kohlenhydraten sind sogenannte Einfachzucker, oder Monosaccharide, die aus einem einzigen Zuckermolekül bestehen. Dazu zählen Traubenzucker, unter Chemikern besser als Glucose bekannt, oder Fruchtzucker, der chemisch als Fructose bezeichnet wird. Sowohl Trauben- als auch Fruchtzucker besteht aus denselben Atomen, sie haben allerdings einen unterschiedlichen Aufbau. Man kann sich chemische Reaktionen ein wenig wie Legospielen vorstellen: Es gibt verschiedene Bausteine, die Atome, und wenn man gewisse Konstruktionsregeln befolgt, lassen sich mit ihnen verschiedene Strukturen, die Moleküle, zusammenbauen. So kommt es, dass man aus genau denselben Atomen zwei unterschiedliche Moleküle zusammensetzen kann.
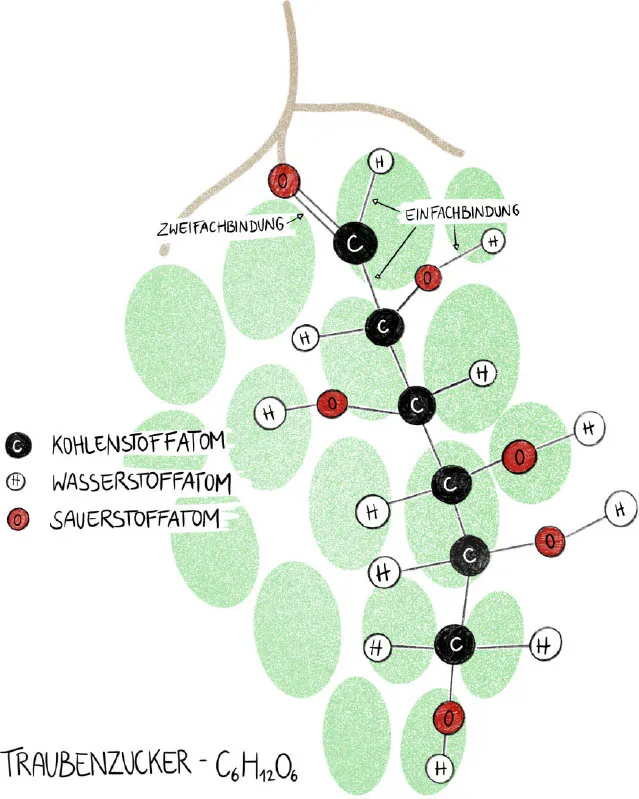
Vereinfacht gesehen, lässt sich der menschliche Körper als eine Art Glucosemotor beschreiben: Traubenzucker ist das Molekül, um das sich in unserem Stoffwechsel alles dreht. Pro Tag verbraucht der menschliche Körper im Ruhezustand rund 200 Gramm Glucose, 75 Prozent davon benötigt allein das...
Inhaltsverzeichnis
- Cover
- Widmung
- Titel
- Impressum
- INHALT
- EINLEITUNG
- KAPITEL 1 CHEMIKALIEN IM ESSEN
- KAPITEL 2 DER KÖRPER ALS CHEMIEBAUKASTEN
- KAPITEL 3 WIE MOLEKÜLE MEDIZINISCH WIRKEN
- KAPITEL 4 DIE ERNÄHRUNG DER WELT
- KAPITEL 5 UND PLÖTZLICH GAB ES PLASTIK
- KAPITEL 6 DIE GASHEIZUNG DER ERDE
- KAPITEL 7 CHEMIE FÜR DIE KLIMAWENDE
- KAPITEL 8 SCHÖNHEIT IN DER CHEMIE
- Dank
- Literatur
- Endnoten