
Übungsbuch Chemie für Dummies
- German
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
Übungsbuch Chemie für Dummies
Über dieses Buch
Sich all die Formeln, Funktionen und Regeln der Chemie zu merken ist schon schwierig genug - und dann soll man sie auch noch richtig anwenden. Da hilft nur üben, üben, üben! Das "Übungsbuch Chemie für Dummies" enthält über 250 Übungen zu Einheitenumrechnung, Periodensystem, Stöchiometrie, Säuren und Basen, Thermodynamik, Redoxreaktionen, funktionelllen Gruppen und vielen anderen grundlegenden Fragestellungen der Chemie. Zudem finden Sie zu Beginn eines jeden Themas eine kurze Widerholung der Theorie, bevor es dann an die Praxis geht. Natürlich gibt es auch ausführliche Lösungen zu allen Aufgaben, so gewinnen Sie Sicherheit und können sich zielgerichtet auf die nächste Prüfung vorbereiten.
Tools to learn more effectively

Saving Books

Keyword Search

Annotating Text

Listen to it instead
Information
Verbindungen aufbauen und erneuern

Bindungen eingehen
- Elektronen bei Ionenbindungen abgeben und aufnehmen
- Elektronen in einer kovalenten Bindung gemeinsam benutzen
- Molekülorbitale verstehen
- Moleküle im Zusammenhang mit VSEPR‐Theorie und Hybridisierung
- Die Idee der Polarität verinnerlichen
- Da die Valenzelektronen von so großer Bedeutung für Bindungen sind, werden sie im Gegensatz zu allen anderen Elektronen manchmal in Form von Punkten um ein Elementsymbol herum dargestellt. Damit lassen sich Bindungsprobleme zwischen Elementen leichter und anschaulicher lösen. Sie sollten in der Lage sein, solche Elektronenpunktstrukturen wie in Abbildung 5.1 darzustellen und zu interpretieren. Diese Abbildung zeigt die Elektronenpunktstrukturen der Elemente der ersten beiden Periodenreihen des Periodensystems; beachten Sie, dass sich die Valenzschalen kontinuierlich von links nach rechts füllen. Um die Elektronenpunktstruktur eines beliebigen Elements zu zeichnen, müssen Sie die Elektronen in der Valenzschale dieses Elements zählen. Dann zeichnen Sie diese Elektronenanzahl in Form von Punkten um das Buchstabensymbol herum. Kapitel 4 beschreibt einige der Faktoren, die festlegen, ob Atome Elektronen verlieren oder dazugewinnen müssen, um Ionen zu bilden. Sie sollten sich sicher sein, dass Sie diese Zusammenhänge verinnerlicht haben, bevor Sie weiter in das vorliegende Kapitel einsteigen.
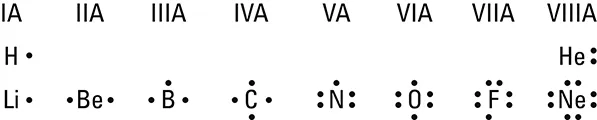
des Periodensystems.
Ladungspaarung bei Ionenbindungen
- Die Atome einiger Elemente, wie Metalle, können ziemlich leicht Valenzelektronen verlieren, um Kationen zu bilden (Atome mit positiver Ladung), die über eine stabile Elektronenkonfiguration verfügen. Atome anderer Elemente, wie die Halogene, können recht einfach Elektronen einfangen, um Anionen zu bilden (Atome mit negativer Ladung), die ebenfalls eine stabile Elektronenkonfiguration besitzen. Kationen und Anionen erfahren eine elektrostatische Anziehung, da sich gegensätzliche Ladungen anziehen. Daher wird sich ein Anion stets an ein Kation kuscheln wollen, sofern die Chance dazu besteht. Dieses Ereignis wird als Ionenbindung bezeichnet und es findet statt, weil die Energie der auf diese Art gebundenen Ionen geringer ist als im Falle ihrer Trennung – kurz gesagt, eine Ionenbindung bietet mehr Stabilität für beide Reaktionspartner.
- Sie können sich eine Ionenbindung als Ergebnis der Übertragung eines Elektrons von Atom zu Atom vorstellen, so wie in Abbildung 5.2 am Beispiel von Natrium und Chlor dargestellt. Metalle (wie Natrium) neigen dazu, Elektronen an Nichtmetalle (wie Chlor) abzugeben, da Nichtmetalle deutlich elektro‐negativ...
Inhaltsverzeichnis
- Cover
- Schummelseite
- Titel
- Impressum
- Über den Autor
- Inhaltsverzeichnis
- Einleitung
- Teil I: Mit Zahlen, Atomen und Elementen anbandeln
- Teil II: Verbindungen aufbauen und erneuern
- Teil III: Veränderungen auf energetischer Ebene betrachten
- Teil IV: Ladung, wechsle dich!
- Teil V: Jetzt wird's organisch
- Teil VI: Der Top‐Ten‐Teil
- Stichwortverzeichnis
Häufig gestellte Fragen
- Elementar ist ideal für Lernende und Profis, die sich mit einer Vielzahl von Themen beschäftigen möchten. Erhalte Zugang zur Basic-Bibliothek mit über 800.000 vertrauenswürdigen Titeln und Bestsellern in den Bereichen Wirtschaft, persönliche Weiterentwicklung und Geisteswissenschaften. Enthält unbegrenzte Lesezeit und die Standardstimme für die Funktion „Vorlesen“.
- Pro: Perfekt für fortgeschrittene Lernende und Forscher, die einen vollständigen, uneingeschränkten Zugang benötigen. Schalte über 1,4 Millionen Bücher zu Hunderten von Themen frei, darunter akademische und hochspezialisierte Titel. Das Pro-Abo umfasst auch erweiterte Funktionen wie Premium-Vorlesen und den Recherche-Assistenten.
Bitte beachte, dass wir Geräte, auf denen die Betriebssysteme iOS 13 und Android 7 oder noch ältere Versionen ausgeführt werden, nicht unterstützen können. Mehr über die Verwendung der App erfahren.