
- German
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
eBook - ePub
Physikalische Chemie für Dummies
Über dieses Buch
Wie die Organische und die Anorganische Chemie ist die Physikalische Chemie eines der klassischen Teilgebiete der Chemie. Wie ihr Name schon sagt, beschäftigt sie sich mit dem Grenzbereich von Chemie und Physik. Georg Heun erklärt Ihnen, was Sie über Kräfte und Elemente, Reinstoffe, Mischungen, Wechselwirkungen und Thermodynamik wissen sollten. Mit vielen Übungen erläutert er so verständlich wie möglich die Grundlagen der Physikalischen Chemie und hilft Ihnen so bei Ihren ersten Schritten in diesem Grenzbereich der Naturwissenschaften.
Häufig gestellte Fragen
Ja, du kannst dein Abo jederzeit über den Tab Abo in deinen Kontoeinstellungen auf der Perlego-Website kündigen. Dein Abo bleibt bis zum Ende deines aktuellen Abrechnungszeitraums aktiv. Erfahre, wie du dein Abo kündigen kannst.
Derzeit stehen all unsere auf mobile Endgeräte reagierenden ePub-Bücher zum Download über die App zur Verfügung. Die meisten unserer PDFs stehen ebenfalls zum Download bereit; wir arbeiten daran, auch die übrigen PDFs zum Download anzubieten, bei denen dies aktuell noch nicht möglich ist. Weitere Informationen hier.
Perlego bietet zwei Pläne an: Elementar and Erweitert
- Elementar ist ideal für Lernende und Interessierte, die gerne eine Vielzahl von Themen erkunden. Greife auf die Elementar-Bibliothek mit über 800.000 professionellen Titeln und Bestsellern aus den Bereichen Wirtschaft, Persönlichkeitsentwicklung und Geisteswissenschaften zu. Mit unbegrenzter Lesezeit und Standard-Vorlesefunktion.
- Erweitert: Perfekt für Fortgeschrittene Studenten und Akademiker, die uneingeschränkten Zugriff benötigen. Schalte über 1,4 Mio. Bücher in Hunderten von Fachgebieten frei. Der Erweitert-Plan enthält außerdem fortgeschrittene Funktionen wie Premium Read Aloud und Research Assistant.
Wir sind ein Online-Abodienst für Lehrbücher, bei dem du für weniger als den Preis eines einzelnen Buches pro Monat Zugang zu einer ganzen Online-Bibliothek erhältst. Mit über 1 Million Büchern zu über 1.000 verschiedenen Themen haben wir bestimmt alles, was du brauchst! Weitere Informationen hier.
Achte auf das Symbol zum Vorlesen in deinem nächsten Buch, um zu sehen, ob du es dir auch anhören kannst. Bei diesem Tool wird dir Text laut vorgelesen, wobei der Text beim Vorlesen auch grafisch hervorgehoben wird. Du kannst das Vorlesen jederzeit anhalten, beschleunigen und verlangsamen. Weitere Informationen hier.
Ja! Du kannst die Perlego-App sowohl auf iOS- als auch auf Android-Geräten verwenden, um jederzeit und überall zu lesen – sogar offline. Perfekt für den Weg zur Arbeit oder wenn du unterwegs bist.
Bitte beachte, dass wir keine Geräte unterstützen können, die mit iOS 13 oder Android 7 oder früheren Versionen laufen. Lerne mehr über die Nutzung der App.
Bitte beachte, dass wir keine Geräte unterstützen können, die mit iOS 13 oder Android 7 oder früheren Versionen laufen. Lerne mehr über die Nutzung der App.
Ja, du hast Zugang zu Physikalische Chemie für Dummies von Georg Heun im PDF- und/oder ePub-Format sowie zu anderen beliebten Büchern aus Naturwissenschaften & Physikalische & theoretische Chemie. Aus unserem Katalog stehen dir über 1 Million Bücher zur Verfügung.
Information
Kapitel 1
Gase unter Druck: Die Gasgesetze
Im ersten Teil geht es um die Einwirkung der physikalischen Größen Temperatur und Kraft oder Druck auf chemische Substanzen. Einer der ersten Chemiker, der maßgeblich die Physikalische Chemie mitbegründet hat, war Joseph Louis Gay-Lussac. Er untersuchte den Einfluss der Temperatur auf das Volumen von Gasen bei konstantem Druck. Das erste Kapitel ist daher dem Zusammenspiel der Einflussgrößen Druck, Volumen und Temperatur bei idealen und realen Gasen gewidmet.
Physik plus Chemie gleich Physikalische Chemie?
Während Ihnen die naturwissenschaftlichen Disziplinen Physik und Chemie aus Ihrer Schulzeit als Unterrichtsfächer bekannt sind, können Sie wahrscheinlich mit der Kombination Physikalische Chemie zunächst einmal wenig anfangen. Gemäß der alten Schülerweisheit, »Chemie ist das, was kracht und stinkt. Physik ist das, was nie gelingt«, könnten Sie vielleicht scherzhaft unterstellen, dass hier chemische Experimente mit niedriger Erfolgsquote durchgeführt werden. Das ist aber nicht der Fall!
Eine klare Abgrenzung zur Physik und zur Allgemeinen und Analytischen Chemie ist häufig nicht vorhanden. So werden Sie feststellen, dass Sie einzelne der in diesem Buch vorgestellten Formeln und Diagramme bereits in anderen Disziplinen kennengelernt haben. Und auf der anderen Seite muss ich damit rechnen, dass man mir vorhält, eine Teildisziplin nicht ausreichend berücksichtigt zu haben.
Das ideale Gas
Für das Verständnis der meisten physikalisch-chemischen Formeln und Phänomene sollten Sie sich das folgende stark vereinfachte Modell der Materie gut einprägen.



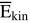



Da die Teilchengröße bei idealen Gasen vernachlässigbar ist, ergibt sich, dass eine gleich große Teilchenzahl eines beliebigen Gases bei gleichem Druck und gleicher Temperatur immer das gleiche Volumen einnimmt.
Aber was bedeuten eigentlich Druck und Temperatur?
Druck
In der Physik haben Sie gelernt, dass der Druck p eine Kraft F pro Fläche A ist (p = F/A). Da sich in einem Gas die Teilchen ungerichtet und mit unterschiedlichen Geschwindigkeiten bewegen, üben sie durch das Aufprallen auf eine Gefäßwand eine Kraft durch die Summe vieler Stöße aus. Bei konstanter Temperatur ist die Kraft auf eine bestimmte Fläche proportional zur Trefferquote. Die Trefferquote wiederum ist direkt proportional zur Teilchendichte, das heißt, wenn in einem Volumen doppelt so viele Teilchen vorhanden sind, verdoppelt sich die Trefferquote und damit die Kraft pro Fläche.
Temperatur
Die Temperatur ist ein Maß f...
Inhaltsverzeichnis
- Cover
- Über den Autor
- Einführung
- Teil I: Kräfte und Substanzen
- Kapitel 1: Gase unter Druck: Die Gasgesetze
- Kapitel 2: Zerreißprobe für Feststoffe – Verformung
- Kapitel 3: Die Sache kommt in Fluss – Viskosität
- Kapitel 4: Übungen
- Teil II: Reinstoffe und Mischungen
- Kapitel 5: Zustandsdiagramme (Phasendiagramme)
- Kapitel 6: Lösungen und Mischungen
- Kapitel 7: Oberflächlich betrachtet: Grenzflächenphänomene
- Kapitel 8: Übungen
- Teil III: Reaktionskinetik
- Kapitel 9: Lassen Sie es krachen: Die chemische Reaktion
- Kapitel 10: Wer mit wem – die Reaktionsordnung
- Kapitel 11: Übungen
- Teil IV: Thermodynamik
- Kapitel 12: Zustands- und Prozessgrößen – die Bausteine der Thermodynamik
- Kapitel 13: Robert von Mayer und der erste Hauptsatz der Thermodynamik – Ein Arzt und die Energieerhaltung
- Kapitel 14: Alles in Unordnung – Der zweite Hauptsatz der Thermodynamik
- Kapitel 15: Zustände und Zustandsänderungen
- Kapitel 16: Links oder rechts – die Kreisprozesse
- Kapitel 17: Gas-Dampf-Gemische – Alles feuchte Luft?
- Kapitel 18: Jetzt wird es brenzlig – Verbrennung
- Kapitel 19: Übungen
- Teil V: Wechselwirkungen
- Kapitel 20: Spektroskopie
- Kapitel 21: Molecular Modeling
- Teil VI: Der Top-Ten-Teil
- Kapitel 22: Zehn (Groß-)Väter der Physikalischen Chemie
- Kapitel 23: Zehn Tipps für Studierende
- Stichwortverzeichnis
- Teil VII: Anhänge
- Anhang A
- Anhang B
- Anhang C
- Anhang D
- Wiley End User License Agreement
