
eBook - ePub
Struktur der Materie
Richard P. Feynman, Robert B. Leighton, Matthew Sands
This is a test
Compartir libro
- 331 páginas
- German
- ePUB (apto para móviles)
- Disponible en iOS y Android
eBook - ePub
Struktur der Materie
Richard P. Feynman, Robert B. Leighton, Matthew Sands
Detalles del libro
Vista previa del libro
Índice
Citas
Información del libro
In seinen legendären Vorlesungen aus dem Jahre 1965 ist es Richard P. Feynman gelungen, die Physik in einer leichtverständlichen Form darzustellen, ohne dabei auf Genauigkeit zu verzichten. Der didaktisch geschickte Aufbau hält den Leser bis an den Schluss gefesselt. Feynman stellt die physikalischen Ideen in den Vordergrund, eine umfassende Kenntnis der exakten mathematischen Grundlagen ist zum Verständnis nicht nötig. Deshalb eignen sich seine Bücher hervorragend sowohl zum Selbststudium als auch als Begleitung zur Vorlesung.
Band 4 in der überarbeiteten New Millennium Edition behandelt die Kondensierte Materie.
Preguntas frecuentes
¿Cómo cancelo mi suscripción?
¿Cómo descargo los libros?
Por el momento, todos nuestros libros ePub adaptables a dispositivos móviles se pueden descargar a través de la aplicación. La mayor parte de nuestros PDF también se puede descargar y ya estamos trabajando para que el resto también sea descargable. Obtén más información aquí.
¿En qué se diferencian los planes de precios?
Ambos planes te permiten acceder por completo a la biblioteca y a todas las funciones de Perlego. Las únicas diferencias son el precio y el período de suscripción: con el plan anual ahorrarás en torno a un 30 % en comparación con 12 meses de un plan mensual.
¿Qué es Perlego?
Somos un servicio de suscripción de libros de texto en línea que te permite acceder a toda una biblioteca en línea por menos de lo que cuesta un libro al mes. Con más de un millón de libros sobre más de 1000 categorías, ¡tenemos todo lo que necesitas! Obtén más información aquí.
¿Perlego ofrece la función de texto a voz?
Busca el símbolo de lectura en voz alta en tu próximo libro para ver si puedes escucharlo. La herramienta de lectura en voz alta lee el texto en voz alta por ti, resaltando el texto a medida que se lee. Puedes pausarla, acelerarla y ralentizarla. Obtén más información aquí.
¿Es Struktur der Materie un PDF/ePUB en línea?
Sí, puedes acceder a Struktur der Materie de Richard P. Feynman, Robert B. Leighton, Matthew Sands en formato PDF o ePUB, así como a otros libros populares de Naturwissenschaften y Physik. Tenemos más de un millón de libros disponibles en nuestro catálogo para que explores.
Información
1Innere Geometrie von Kristallen
Siehe auch: Ch. Kittel: Einführung in die Festkörperphysik, Oldenbourg Wissenschaftsverlag, München
1.1Die innere Geometrie von Kristallen
Wir haben die Darlegung der grundlegenden Gesetze der Elektrizität und des Magnetismus beendet und wollen nun die elektromagnetischen Eigenschaften der Materie untersuchen. Wir beginnen mit der Beschreibung von Festkörpern – und zwar mit Kristallen. Bewegen sich die Atome der Materie nur geringfügig, so bleiben sie beieinander und bilden eine Anordnung mit möglichst niedriger Energie. Haben die Atome an einem bestimmten Ort ein Muster gefunden, das einer niedrigen Energie entspricht, so werden sich die Atome an anderen Stellen wahrscheinlich in derselben Form anordnen. Deshalb finden wir in festen Materialien ein sich wiederholendes Muster der Atome vor.
Die Bedingungen in einem Kristall sind also die folgenden: Die Umgebung eines gegebenen Atoms in einem Kristall stellt eine bestimmte Anordnung dar und wenn Sie dieselbe Atomsorte an einem anderen Ort in einigem Abstand dazu betrachten, so finden Sie ein Atom mit genau der gleichen Umgebung. Wählen Sie dann ein Atom, das noch einmal um den gleichen Abstand weiter entfernt liegt, so stellen Sie auch da wieder dieselben Bedingungen fest. Das Muster wiederholt sich endlos – und das natürlich in drei Dimensionen.
Stellen Sie sich vor, Sie sollen ein Muster für eine Tapete entwerfen – oder für einen Stoff oder für eine beliebige andere ebene Fläche – bei dem sich ein Element geometrisch ständig wiederholt, sodass Sie die Fläche nach Belieben vergrößern können. Das ist das zweidimensionale Analogon zu dem Problem, das ein Kristall in drei Dimensionen löst. Abbildung 1.1 (a) zeigt zum Beispiel ein sehr häuflg anzutreffendes Tapetenmuster.
Durch ständige Wiederholung eines einzigen Elementes entsteht ein Muster, das immer weiter fortgesetzt werden kann. Die geometrischen Charakteristika dieses Tapetenentwurfs sind in Abbildung 1.1 (b) angegeben, wobei nur seine Wiederholungseigenschaften, nicht aber die Geometrie der Blume oder sein künstlerischer Wert beachtet sind. Beginnen Sie an einem beliebigen Punkt, so können Sie den entsprechenden Punkt finden, wenn Sie in der Richtung von Pfeil 1 den Abstand a zurücklegen. Einen entsprechenden Punkt können Sie aber auch finden, wenn Sie in der Richtung von Pfeil 2 den Abstand b zurücklegen. Es sind natürlich noch viele andere Richtungen möglich. Sie können beispielsweise vom Punkt α zum Punkt β gehen und erreichen einen entsprechenden Punkt, doch ein solcher Schritt kann als eine Kombination aus einem Schritt in Richtung 1 und einem Schritt in Richtung 2 betrachtet werden. Eine der grundlegenden Eigenschaften des Musters kann durch die beiden kürzesten Schritte zu äquiva-lenten Nachbarorten beschrieben werden. Mit „äquivalenten“ Orten wollen wir sagen, dass es keine Rolle spielt, ob Sie an dem einen oder an dem anderen Ort stehen: wenn Sie sich umschauen, sehen Sie beide Male dasselbe. Das ist die grundlegende Eigenschaft eines Kristalls.
Der einzige Unterschied besteht darin, dass ein Kristall keine zweidimensionale, sondern eine dreidimensionale Anordnung ist; und anstelle der Blumen ist natürlich jedes Element des Gitters eine Anordnung von Atomen – vielleicht sechs WasserStoff- und zwei KohlenStoffatome –, die ein bestimmtes Muster bilden. Das Atommuster in einem Kristall lässt sich experimentell durch Röntgenbeugung ermitteln. Wir haben diese Methode früher kurz erwähnt und wollen jetzt nichts weiter dazu sagen, außer, dass man damit für die meisten einfachen und für einige kompliziertere Kristalle die genaue Anordnung der Atome im Raum festgestellt hat.
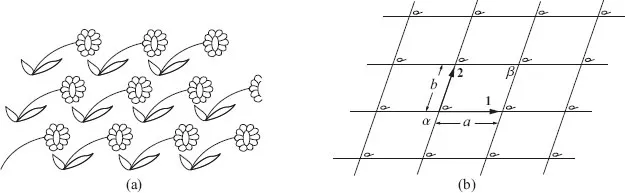
Abb. 1.1: Ein sich ständig wiederholendes Muster in zwei Dimensionen.
Die innere Struktur eines Kristalls äußert sich auf verschiedene Weise. Erstens ist gewöhnlich die Bindungskraft der Atome in einigen Richtungen stärker als in anderen. Das bedeutet, dass es in dem Kristall bestimmte Ebenen gibt, an denen er leichter zerbricht. Sie werden Spaltebenen genannt. Zerbrechen Sie einen Kristall mit einer Messerklinge, so wird er häufig entlang einer solchen Ebene zerspringen. Zweitens hängt die Tatsache, dass die innere Struktur oft schon auf der Oberfläche zu erkennen ist, mit der Entstehung des Kristalls zusammen. Stellen Sie sich einen Kristall vor, der aus einer Lösung abgeschieden wird. Die Atome schwimmen in der Lösung und setzen sich schließlich ab, wenn sie einen Ort mit der niedrigsten Energie finden. (Als ob die Tapete aus Blumen entstünde, die zunächst umherdriften, bis eine von ihnen einen Platz einnimmt und dort steckenbleibt und desgleichen die nächste und die nächste, sodass das Muster nach und nach wächst.) Sie können verstehen, dass der Kristall in gewissen Richtungen mit einer anderen Geschwindigkeit als in anderen Richtungen wächst und dabei eine bestimmte geometrische Gestalt entwickelt. Aufgrund solcher Effekte lassen die äußeren Oberflächen vieler Kristalle einiges bezüglich der inneren Anordnung der Atome erkennen.
Zum Beispiel zeigt Abbildung 1.2 (a) die Form eines typischen Quarzkristalls, dessen inneres Muster hexagonal ist. Betrachten Sie einen solchen Kristall aus der Nähe, so werden Sie feststellen, dass das Äußere kein sehr schönes Hexagon darstellt, weil die Seiten nicht alle gleich lang sind – tatsächlich sind sie oft sehr ungleich. Aber in einer Hinsicht ist er ein sehr gutes Hexagon: die Winkel zwischen den Flächen sind genau 120°. Die Größe einer gegebenen Fläche ist o?ensichtlich ein Zufall des Wachstums, aber die Winkel sind eine Widerspiegelung der inneren Geometrie. Folglich hat jeder Quarzkristall eine andere Form, obwohl die Winkel zwischen entsprechenden Flächen immer dieselben sind.
Auch die innere Geometrie eines Natriumchloridkristalls ist aus seiner äußeren Form ersichtlich. Abbildung 1.2 (b) zeigt die Gestalt eines typischen Salzkorns. Wiederum ist der Kristall kein vollkommener Würfel, aber die Flächen liegen genau im rechten Winkel zueinander.

Abb. 1.2: Natürliche Kristalle: (a) Quarz, (b) Natriumchlorid, (c) Glimmer.
Ein komplizierterer Kristall ist Glimmer, der die in Abbildung 1.2 (c) gezeigte Form hat. Es handelt sich um einen höchst anisotropen Kristall, was aus der Tatsache hervorgeht, dass er sehr hart ist, wenn Sie versuchen, ihn in der einen Richtung (der horizontalen in der Abbildung) auseinanderzubrechen und dass er in der anderen Richtung (der vertikalen) sehr leicht zu zerbrechen ist. Er wurde häufig verwendet, um dünne, sehr widerstandsfähige Blätter herzustellen. Glimmer und Quarz sind zwei Beispiele für natürliche Mineralien, die Kieselsäure enthalten. Ein drittes Beispiel für ein Mineral mit Kieselsäure ist Asbest, der die interessante Eigenschaft aufweist, dass er sich in zwei Richtungen leicht zerbrechen lässt, aber nicht in der dritten. Er scheint aus sehr starken, linearen Fasern zu bestehen.
1.2Chemische Bindung in Kristallen
Die mechanischen Eigenschaften der Kristalle hängen stark von der Art der chemischen Bindungen zwischen den Atomen ab. Die so frappierend unterschiedliche Festigkeit von Glimmer in verschiedenen Richtungen hängt von den Typen der interatomaren Bindung in den verschiedenen Richtungen ab. Zweifellos haben Sie schon im Chemieunterricht etwas von den verschiedenen Bindungstypen gehört. Als Erstes gibt es die Ionenbindungen, die wir bereits im Fall von Natriumchlorid untersucht haben. Grob gesprochen geht es um das Folgende: Die Natriumatome haben ein Elektron verloren und sind zu positiven Ionen geworden; die Chloratome haben ein Elektron dazugewonnen und sind zu negativen Ionen geworden. Die positiven und die negativen Ionen sind in Form eines dreidimensionalen Schachbretts angeordnet und werden von elektrischen Kräften zusammengehalten.
Die kovalente Bindung – in der die Elektronen zu zwei Atomen gleichzeitig gehören – tritt häuflger auf und ist gewöhnlich sehr stark. Beispielsweise haben in einem Diamanten die KohlenStoffatome kovalente Bindungen in den vier Richtungen ihrer nächsten Nachbarn, sodass der Kristall wirklich sehr fest ist. Es existieren auch kovalente Bindungen zwischen dem Silizium und dem SauerStoff in einem Quarzkristall, aber in dem Fall ist die Bindung nur teilweise kovalent. Da nicht alle Atome einen gleichen Anteil an den Elektronen haben, sind sie teilweise geladen, und der Kristall ist etwas ionisch. Die Natur ist nicht so einfach, wie wir sie gerne hätten; in Wirklichkeit gibt es alle möglichen Abstufungen zwischen der kovalenten Bindung und der Ionenbindung.
Ein Zuckerkristall hat wieder einen anderen Bindungstyp. Er besteht aus großen Molekülen, in denen die Atome durch kovalente Bindungen fest zusammengehalten werden, sodass das Molekül eine feste Struktur hat. Aber da die starken Bindungen vollständig abgesättigt sind, gibt es nur eine verhältnismäßig schwache Anziehung zwischen den einzelnen Molekülen. In solchen Molekular kristallen bewahren die Moleküle gewissermaßen ihre eigene Identität, und die innere Struktur kann wie die in Abbildung 1.3 dargestellt werden. Da die Moleküle untereinander nicht fest zusammengehalten werden, sin...