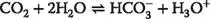Die schwache Brønsted-Säure Wasser wird deutlich saurer, wenn sie an die Lewis-Säure Zn2+ koordiniert. Die konjugierte Base OH– steht im aktiven Zentrum des Enzyms in hoher Konzentration als zinkgebundenes Nukleophil zur Verfügung. Im aktiven Zentrum des Enzyms findet so Säure-Base-Katalyse bei konstantem pH-Wert statt.
Zinkenzyme
Für den Menschen sind nur wenige Übergangsmetalle essenziell. Wird die bloße Menge an Metall betrachtet, so finden sich im Grammbereich lediglich Eisen mit ≈ 3−5 g und Zink mit 2 g, im 100-mg-Bereich Kupfer. Cobalt, Mangan und Molybdän treten hinter diese drei wichtigsten Elemente zurück – vor allem, wenn die Zahl an Enzymen betrachtet wird, die das jeweilige Metall enthalten. Gerade bei Zink zeigt sich dabei der Zusammenhang zwischen den verfügbaren Detektionsmethoden und dem Erkennen eines Proteins als Zinkenzym. Als diamagnetisches, farbloses d10-Ion ohne Redoxchemie fallen nämlich einige Detektionsmöglichkeiten aus. So bleiben, von der Röntgenstrukturanalyse an Einkristallen abgesehen, die Atomabsorptionsspektroskopieund – als Methode zur Detektion nicht zu fest gebundenen Zinks – die Fluoreszenzspektroskopie an Zinkchelaten, die ihre fluoreszierenden Eigenschaften nur im zinkgebundenen Zustand zeigen, nicht für den freien Ligand. Ein Motiv für die intensive Suche nach weiteren Zinkproteinen ist ein genetischer Befund. Abhängig von den angewandten Kriterien zeigt die Sequenz der menschlichen DNA an, dass 3–10 % des Genoms Zinkproteine codieren. Für den oberen Wert hieße dies, dass der Mensch ca. 3000 Zinkenzyme ausbilden könnte, von denen bislang nur ca. 200 bekannt sind.
1.1 Carboanhydrasen
Carboanhydrasen sind im Tier- und Pflanzenreich weit verbreitet. Eine Carboanhydrase (CA) war das erste der heute bekannten Enzyme, die als Zinkenzyme erkannt wurden. Genetisch werden verschiedene CA-Familien unterschieden (α-, β-, γ-, δ- und ζ-CAs). Im Menschen kommen α-CAs vor, die ihrerseits wieder in derzeit 15 verschiedene Formen („Isozyme“) zerfallen. Die Formenvielfalt spiegelt wider, dass CAs zahlreiche Aufgaben haben, so sind sie auch beim ständigen Umbau des Skeletts beteiligt (biologischer Apatit enthält Carbonat). Da sie außerdem bei vielen Krankheitsbildern eine Rolle spielen, sind CAs Ziel der Wirkstoffentwicklung.
Die von CA katalysierte Reaktion mutet fast primitiv an, da „nur“ eine Gleichgewichtseinstellung zwischen Lösung und Gasraum vorbereitet wird – so katalysiert bei uns Menschen Carboanhydrase II die Reaktion zwischen dem Hydrogencarbonat des Blutplasmas und dem Kohlendioxid in den Lungenbläschen:
Dass dieser einfache Vorgang kinetisch gehemmt ist und der Katalyse bedarf, erkennt man spätestens dann, wenn man im Biergarten vor einer frisch gezapften Maß sitzt. Auch nach längerer Zeit „bitzelt“ ein Schluck auf der Zunge. Es wird also noch Kohlensäure freigesetzt, die (Gott sei Dank) eben nicht in den ersten Sekunden nach dem Zapfen die wässrige Phase verlassen hat, um so das thermodynamische Gleichgewicht einzustellen – wirksames Veratmen von CO2 ist unkatalysiert also offensichtlich nicht möglich. (Auch das Prickeln auf der Zunge wird übrigens durch eine dort lokalisierte Carboanhydrase IV bewirkt [10].)
1.1.1 Molekülbau von humaner Carboanhydrase II (hCA II)
Die meisten CAs bestehen aus einem einzelnen Proteinstrang von ca. 260 Aminosäuren. Es sind mehr als 400 Strukturanalysen an CAs und CA-Hemmstoff-Komplexen in der PDB hinterlegt (abzufragen unter carbonic anhydrase). Die durch β-Faltblatt- und ungeordnete Abschnitte charakterisierte Molekülstruktur von humaner Carboanhydrase II ist in Abb. 1.1 gezeigt.
Im aktiven Zentrum binden drei Histidinreste ein vierfach koordiniertes Zinkion (Abb. 1.2). Die vierte Koordinationsstelle wird von einem Aqua/Hydroxido-Liganden belegt. Unter den Aminosäureseitenketten in der näheren Umgebung des aktiven Zentrums wird der Histidin-64-Rest in der Rolle eines Protonenüberträgers gesehen. Es liegen Strukturanalysen vor, die sowohl CO2-beladene hCA II zeigen, als auch dasselbe Enzym in der Hydrogencarbonatform. Beide Zustände sind durch Wasserstoffbrückenbindungen charakterisiert, in die der Aqua/Hydroxido-Ligand, zwei Wassermoleküle im typischen 3-Å-Abstand und die Hydroxygruppe einer Threoninseitenkette eingebunden sind. In der CO2-beladenen Form ist das Kohlendioxidmolekül über weitere Wasserstoffbrückenbindungen für den Angriff eines OH−-Nukleophils räumlich korrekt positioniert (in zinkfreier CA führt die Beladung mit CO2 zu derselben räumlichen Anordnung des Substrats). Abbildung 1.2 zeigt das Ergebnis der Strukturanalyse; zur besseren...