
eBook - ePub
L'Alcahest Quantique
« Retour à la source »
Frédéric Cordier
This is a test
Buch teilen
- 376 Seiten
- French
- ePUB (handyfreundlich)
- Über iOS und Android verfügbar
eBook - ePub
L'Alcahest Quantique
« Retour à la source »
Frédéric Cordier
Angaben zum Buch
Buchvorschau
Inhaltsverzeichnis
Quellenangaben
Über dieses Buch
L'Alcahest Quantique se propose de vous décrire l'Univers d'un point de vue unique en son genre. Il est le Résultat de 7 années de recherches, d'analyses et de mise en synthèse, dans les divers domaines de la science.La vision de l'Univers que l'auteur a développé au travers de ce livre, vous permettra de découvrir qu'en définitive, tout est exactement à sa place, en tout instant et en toute circonstances. Rien n'est dû au hasard. Cette vue de l'Univers est à 99% compatible avec les connaissances et résultats scientifiques actuels, et se propose de revoir uniquement quelques détails, qui pouvant sembler insignifiants, changent en réalité beaucoup de choses dans la manière d'aborder l'Univers, son écoute, et sa compréhension.
Häufig gestellte Fragen
Wie kann ich mein Abo kündigen?
Gehe einfach zum Kontobereich in den Einstellungen und klicke auf „Abo kündigen“ – ganz einfach. Nachdem du gekündigt hast, bleibt deine Mitgliedschaft für den verbleibenden Abozeitraum, den du bereits bezahlt hast, aktiv. Mehr Informationen hier.
(Wie) Kann ich Bücher herunterladen?
Derzeit stehen all unsere auf Mobilgeräte reagierenden ePub-Bücher zum Download über die App zur Verfügung. Die meisten unserer PDFs stehen ebenfalls zum Download bereit; wir arbeiten daran, auch die übrigen PDFs zum Download anzubieten, bei denen dies aktuell noch nicht möglich ist. Weitere Informationen hier.
Welcher Unterschied besteht bei den Preisen zwischen den Aboplänen?
Mit beiden Aboplänen erhältst du vollen Zugang zur Bibliothek und allen Funktionen von Perlego. Die einzigen Unterschiede bestehen im Preis und dem Abozeitraum: Mit dem Jahresabo sparst du auf 12 Monate gerechnet im Vergleich zum Monatsabo rund 30 %.
Was ist Perlego?
Wir sind ein Online-Abodienst für Lehrbücher, bei dem du für weniger als den Preis eines einzelnen Buches pro Monat Zugang zu einer ganzen Online-Bibliothek erhältst. Mit über 1 Million Büchern zu über 1.000 verschiedenen Themen haben wir bestimmt alles, was du brauchst! Weitere Informationen hier.
Unterstützt Perlego Text-zu-Sprache?
Achte auf das Symbol zum Vorlesen in deinem nächsten Buch, um zu sehen, ob du es dir auch anhören kannst. Bei diesem Tool wird dir Text laut vorgelesen, wobei der Text beim Vorlesen auch grafisch hervorgehoben wird. Du kannst das Vorlesen jederzeit anhalten, beschleunigen und verlangsamen. Weitere Informationen hier.
Ist L'Alcahest Quantique als Online-PDF/ePub verfügbar?
Ja, du hast Zugang zu L'Alcahest Quantique von Frédéric Cordier im PDF- und/oder ePub-Format sowie zu anderen beliebten Büchern aus Philosophie & Geschichte & Theorie der Philosophie. Aus unserem Katalog stehen dir über 1 Million Bücher zur Verfügung.
Information
1ère partie
Histoire d’Atomes et de particules.
- Avant propos
- Naissance de l’atome
- Naissance de l’électron
- Mendeleïev et le tableau périodique des éléments
- L’atome de Rutherford
- L’atome de Bohr – mesure d’absorption et émission de photons
- Naissance de la relativité
- Les débuts de la mécanique quantique
- Fonction d’onde
- Interactions - lumière et atomes
- Etat quantique des électrons
- Forces atomiques
Avant propos
Cette partie du livre a un but purement informationnel. Elle va retracer certaines découvertes scientifiques concernant la physique quantique, la relativité et la cosmologie pour que le lecteur puisse se faire une idée partielle de « comment la science a évolué au cours des siècles » pour en arriver aux règles et lois actuelles de notre science moderne. L’objectif n’est pas de retracer l’entièreté de l’évolution de la science au cours des siècles, mais juste de donner des informations sur les découvertes qui sont liées aux besoins de la théorie exposée en troisième partie du livre.
Naissance de l’atome.
L’étymologie du nom « atome8 » nous renvoie directement à l’époque des philosophes de la Grèce Antique. Démocrite9, puis Épicure10, pensent que la matière est constituée de très petits éléments, ou grains, qui ne peuvent pas être divisés. Épicure pense d’ailleurs que l’âme n’est qu’un composé d’atomes. Même s’ils considéraient l’atome comme étant un élément indivisible et indestructible, ils avaient déjà émis l’idée que cet atome était composé d’une infinité d’éléments plus petits. Ce qui, au fil des années et des découvertes scientifiques, s’est révélé être exact. Ils sont la preuve qu’une bonne intuition peut parfois dépasser les résultats observables et mener à une compréhension plus élevée de la réalité.
Il aura alors fallu attendre le début du XIXe siècle pour qu’une théorie atomique et moléculaire soit formulée par la science. La théorie de John Dalton11, définissant que la matière est composée d’atomes de masses différents, se combinant selon de simples proportions et, définissant aussi que les corps simples sont composés d’atomes semblables entre eux mais, que deux corps simples différents sont composés d’atomes différents. Cette notion fut nécessaire pour réunir en une théorie cohérente les diverses lois de la chimie. A ce moment là de l’histoire, l’atome conserve toujours son caractère indivisible et irréductible.
Naissance de l’électron
Il faudra attendre la fin du XIXe siècle pour que soit mise en doute la notion d’irréductibilité de l’atome. Les travaux de Joseph John Thomson12 sur les gaz raréfiés soumis à des décharges électriques et les travaux de Hendrik Antoon Lorentz13 sur l’étude des particules dans les tubes cathodique ont mené à la découverte des électrons.
Lorentz a considéré l’électron comme une unité composante de tous les atomes. Il s’agit d’une petite particule possédant une charge électrique négative et dont la masse est d’environ 2000 fois plus petite que celle de l’atome d’hydrogène. L’électron devient alors, la plus petite particule déterminée expérimentalement. Cette découverte fut l’aboutissement des travaux de Michael Faraday14 et James Clerk Maxwell15 et permis de donner une description simple aux phénomènes électromagnétiques dont la conclusion la plus importante fut l’identification des ondes lumineuses à des ondes électromagnétiques. Ce fut aussi à ce moment là que fut énoncé l’hypothèse selon laquelle les électrons sont animés d’un mouvement vibratoire au sein même des atomes. C’est ainsi qu’est né l’atome de Thomson-Lorentz.
Mendeleïev et le tableau périodique des éléments
En 1869, Dmitri Ivanovitch Mendeleïev16 pensait que les éléments chimiques pouvaient être arrangés selon un modèle qui permettrait de prévoir les propriétés des éléments non encore découverts. Il a donc mis en place un tableau de classification des éléments que l’on nomme communément le « tableau périodique des éléments », également appelé parfois la « table de Meldeleïev ». Il révéla, à propos de sa découverte : « j’ai vu dans un rêve un tableau où tous les éléments tombaient à la bonne place ». Une représentation de la version actuelle du tableau périodique des éléments est disponible en annexe 1.
Voici une copie du tableau de classification périodique publié par Mendeleïev en 1869: 17

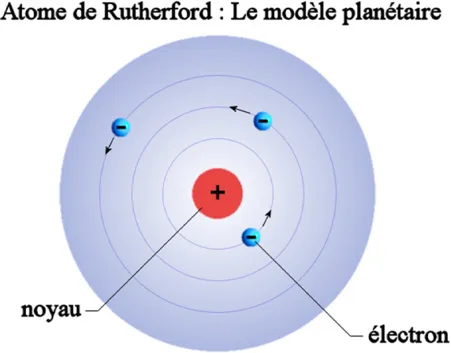
L’atome de Rutherford
En 1911, Ernest Rutherford18 et ses collaborateurs, en vue d’étudier la distribution des charges positives de l’atome ont effectués une série d’expériences capitales. Ces expériences ont démontré que les protons ne pouvaient pas se trouver dans l’entièreté de l’espace atomique mais plutôt dans une espace restreint que l’on nomme le noyau atomique. Ils démontrèrent aussi que les électrons ne se trouvaient pas dans le noyau atomique mais à l’extérieur de ce dernier, en occupant tout l’espace disponible, les décrivant ainsi comme étant soumis à l’action des forces électromagnétiques. Ce modèle définit par Rutherford identifie la structure de l’atome à celle d’un système planétaire où le noyau joue le rôle du soleil et les électrons celui des planètes. Ce modèle anéantit ainsi l’antique conception de l’atome définit en tant qu’unité indivisible de la matière tout en opérant une unification radicale permettant de représenter la matière atomique comme un ensemble de configurations d’électrons et de noyaux.
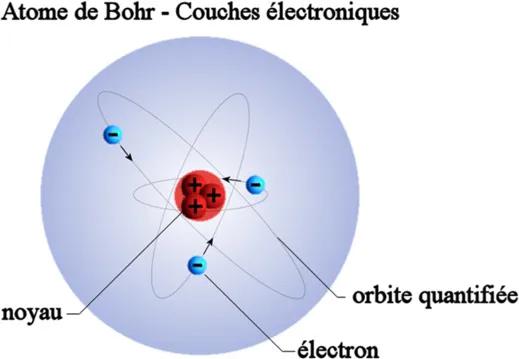
L’atome de Bohr – mesure d’absorption et émission de photons
En 1914, Niels Bohr19 considère que le modèle atomique de Rutherford est instable car un déplacement permanent des électrons provoquerait une instabilité majeure de l’atome. Ainsi, en se basant sur les travaux de Rutherford, et en utilisant la conception quantique de Max Planck20 et d’Albert Einstein21, Niels Bohr a écarté ce défaut et a pu établir deux nouveaux postulats concernant l’électron, permettant ainsi à l’énergie d’un photon, émis ou absorbé par un atome, de représenter la mesure de la différence entre l’énergie initiale et finale de l’atome. Il propose ainsi un modèle atomique sensiblement différent de celui de Rutherford, et dans lequel les électrons se trouvent sur des orbites particulières qu’il nommera les couches électroniques (ou niveaux énergétiques). L’énergie d’un électron lorsqu’il se trouve sur sa couche fondamentale est constante, ce qui implique qu’il n’y a aucune émission d’énergie lorsque l’électron se trouve sur cette couche et donc, qu’il n’y a pas de perte d’énergie. Le numéro atomique de l’atome (dans le tableau de classification) est égal au nombre d’électrons présents dans l’atome. Par exemple, l’hydrogène possède un seul électron, l’oxygène en possède 8, et l’uranium 92. Un atome peut contenir jusqu’à 7 couches d’électrons sachant que chacune d’entre elles peuvent accueillir un nombre déterminé d’électrons. La septième couche n’est complète pour aucun des éléments naturels connus. De plus, les électrons du dernier niveau d’énergie (ou dernière couche électronique non vide) sont responsables des propriétés de l’atome concerné.
Naissance de la relativité22
En 1905, Einstein publie un article sur la relativité restreinte. Cette idée germait déjà dans l’esprit des scientifiques de l’époque tels que Henri Poincaré23 et Hendrik Antoon Lorentz. Après avoir établi la relativité restreinte, il énonça deux ans après, ce qu’il appellera le principe d’équivalence entre gravité et accélération constante. Cependant, il lui faudra encore huit longues années avant d’établir, en fin 1915, la théorie de la relativité générale, représentant les fondements définitifs d’une théorie géométrique de la gravitation. En 1919, une éclipse solaire permet à Einstein de mesurer la déviation d’un rayon lumineux par le soleil, permettant de valider une des prédictions de la relativité générale qui consiste en l’action de la gravitation sur la lumière En 1932, Einstein publie avec De Sitter, le premier modèle d’Univers en expansion. A cette époque, la relativité générale24 attire beaucoup moins les scientifiques car, l’arrivée depuis quelques années de la physique quantique remets pas mal de théories et d’idées en question. La théorie de la relativité générale est restée, aux yeux de la majorité des physiciens, une théorie ésotérique, et ce pendant plus d’une cinquantaine d’années. A partir de 1955, après la mort d’Einstein, la théorie de la re...