
Inorganic Chemistry
Some New Facets
Ram Charitra Maurya
- 663 pages
- English
- ePUB (adapté aux mobiles)
- Disponible sur iOS et Android
Inorganic Chemistry
Some New Facets
Ram Charitra Maurya
À propos de ce livre
This book covers different aspects of Inorganic Chemistry in terms of 10 Chapters with in-depth and up-to-date coverage. Starting with the VSEPR theory in the first chapter, the book symmetrically presents delocalized p-bonding in polyatomic molecules; structure, bonding and topology of borane and related compounds; synthesis and reactivity of metal clusters and their bonding; some aspects of stability constants of metal complexes; magnetochemistry; mechanism of inorganic reactions; molecular orbital (MO) approach of bonding in transition metals; bonding in organometallic sandwich compounds based on MO approach. Safe and economical inorganic experiments at UG and PG Levels are also presented in the last chapter. At the end, five relevant topics are included as appendices for updating students and faculty members.
Foire aux questions
Informations
Chapter I Valence shell electron pair repulsion (VSEPR) theory: principles and applications
1.1 Introduction
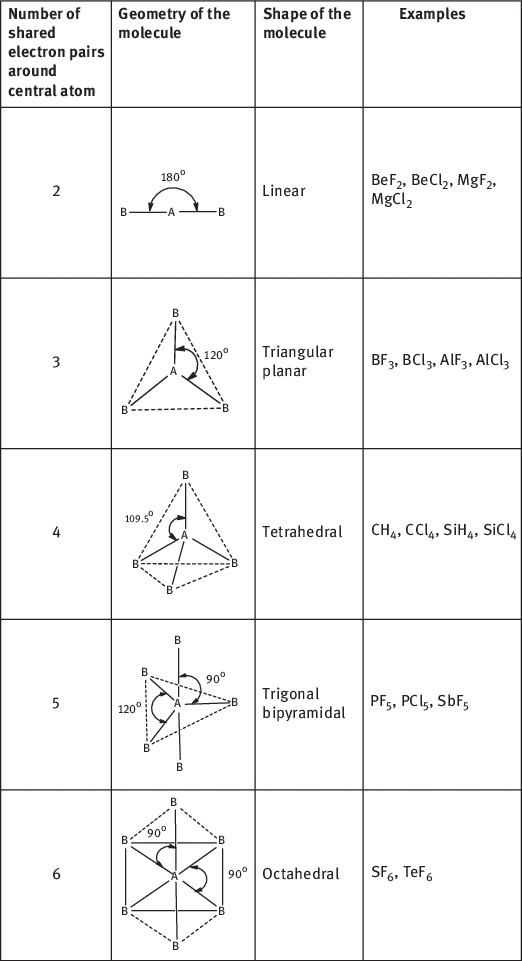
1.2 Postulates of VSEPR theory: Sidgwick and Powell
- The unpaired electrons in the valence shell of central atom form bond pairs (bps) with surrounding atoms while paired electrons remain as lone pairs (lps).
- The electron pairs surrounding the central atom repel each other. Consequently, they stay as far apart as possible in space to attain stability.
- The geometry and shape of the molecule depend upon the number of electron pairs (bond pair as well as lone pair) around the central atom.
- The geometrical arrangements of electron pairs with different number of electron pairs around central atom are given in Table 1.1.
 |