![]()
Anne Gompf
1Grundlagen der Durchflusszytometrie
1.1Einleitung
Ein Durchflusszytometer ist im Grunde genommen ein automatisiertes Fluoreszenzmikroskop. Durchflusszytometrisch können oberflächliche und innere Merkmale von biologischen Einzelzellen oder ähnlich großen Partikeln in einer durch das Zytometer fließenden Suspension bestimmt werden, die als optische Eigenschaften mittels Lichtstreuung und Fluoreszenzmarkierung für das Gerät detektierbar gemacht worden sind.
Dabei wird der Begriff FACS = fluorescence-activated cell sorting oder sorter, der eigentlich Zellsortierung bedeutet und eine Handelsmarke ist, synonym für die analytische Durchflusszytometrie gebraucht.
Ähnlich wie im Mikroskop werden auch im Durchflusszytometer die zu beurteilenden Objekte (Zellen) beleuchtet. Allein die Dauer dieser Beleuchtung ist bei letzterem mit ungefähr einer bis zehn Mikrosekunden um ein Vielfaches kürzer. Damit lässt sich eine schnellere Beurteilung des einzelnen Objekts und damit der ganzen Probe erreichen, bedingt aber auch den Einsatz von Lichtquellen höherer Intensität (Laser).
Für die Durchflusszytometrie geeignete Partikel sind klassischerweise 0,2 μm bis 150 μm groß und können eukaryotische Einzelzellen, Bakterien oder auch Chromosomen oder Beads sein. Zellen aus Gewebeverbänden müssen (mechanisch, enzymatisch) aus diesen herausgelöst werden um eine Einzelzellsuspension herzustellen.
In diesem Kapitel soll neben dem Aufbau und der Funktionsweise eines Durchflusszytometers auch Fluoreszenz als solche und deren Nutzung in der Durchflusszytometrie besprochen werden.
1.2Durchflusszytometer
1.2.1Das Flüssigkeitssystem
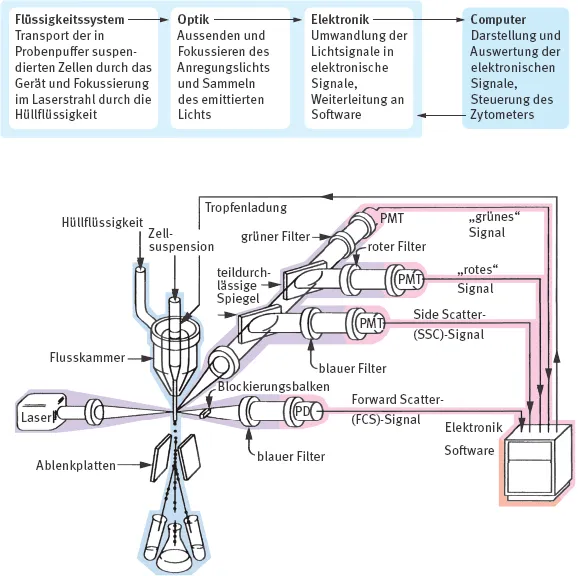
Zellen in Einzelzellsuspension in Pufferlösung fließen als Probenstrom durch das System vorbei an einem oder mehreren Lasern – danach im Fall der reinen Analyse in den Müll, im Fall der Sortierung werden jetzt gewünschte Populationen aufgefangen (Abb. 1.1).
Für eine gleichmäßige Anregung der Fluorochrome ist es wichtig, dass die Zellen in der Probe einzeln nacheinander in einem Fokuspunkt an den Lasern vorbeifließen.
Abb. 1.1: Funktionsprinzip und schematische Darstellung eines einfachen Durchflusszytometers mit Laser, Streulicht- und Fluoreszenzdetektoren und Sortierfunktion. PD = Photodiode, PMT = Photomultiplier Tube (modifiziert nach Givan, 2001; abgedruckt mit Genehmigung von John Wiley Sons, Inc.).
Dazu wird in den meisten Durchflusszytometern der Probenstrom in der Flusskammer (Flow Chamber, Flow Cell) in die Mitte des Hüllstroms injiziert und dort als Kernstrom hydrodynamisch fokussiert: dank des Druckgefälles zwischen Hüllund Probenstrom wandern die Zellen ins Zentrum des Stroms (Bernoulli-Effekt).
Die Hüllflüssigkeit ist in nahezu allen Fällen eine gepufferte Salzlösung (PBS), da biologische Zellen darin überleben und da vor allem zum Sortieren eine leitfähige Flüssigkeit benötigt wird. In Analysemaschinen kann theoretisch auch Wasser als Hüllflüssigkeit verwendet werden, da sich bei laminaren Strömen Hüll- und Probenstrom nicht vermischen.
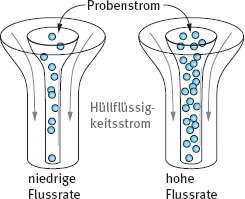
Abb. 1.2: Schematische Darstellung eines Teils einer Flusszelle mit niedriger und hoher Flussrate – schmalem und breitem Probenstrom – während der hydrodynamischen Fokussierung.
Bei Erhöhung der Probenflussrate wird der Kernstrom durch Drucksteigerung im Probenstrom verbreitert und es können mehr Zellen pro Zeiteinheit gemessen werden (Abb. 1.2). Da auf Grund des breiteren Probenstroms einzelne Zellen nicht mehr genau im Laserfokus liegen, werden die Signale bei schnellerer Messung unschärfer.
Die Signalunschärfe bei schneller Messung und die außerdem auf Grund der Scherkräfte während der hydrodynamischen Fokussierung auftretende Deformation der Partikel können z. B. in Geräten mit akustischer Fokussierung umgangen werden (Attune®, life Technologies). Hier werden die zu untersuchenden Partikel mittels Schallwellen von über 2 MHz aus einem piezzoelektrischen Ultraschallgerät fokussiert. Daneben gibt es noch das Guava® easyCyteTM-System von Merck Millipore, welches mittels Spritzenpumpe den reinen Probenstrom durch eine Mikrokapillare schickt und so völlig ohne Hüllflüssigkeit auskommt.
Geräte, in denen die Zellsuspension mit Spritzenpumpen eingebracht werden wie z. B. bei Attune® und Guava®, aber auch Geräte, in denen die Probe mit Vakuum angesaugt wird wie beim BD FACSVerseTM, erlauben dank genau definierter Volumina außerdem die Bestimmung der Zellkonzentration in der Probe.
In durchflusszytometrischen Analysegeräten folgt auf den Schnittpunkt von fokussierten Zellen mit Laserstrahl(en) die Entsorgung der jetzt vermessenen Probe. Mit Zellsortiergeräten können an dieser Stelle mehrere über die soeben gemessenen Eigenschaften charakterisierte Zellsubpopulationen aufgefangen und weiteren Analysen zugeführt werden.
Die Sortierung von Zellen ist eigentlich eine Sortierung von Tropfen, in denen sich jeweils eine Zelle befindet. Dazu wird der Strom aus Probe und Hüllflüssigkeit in Schwingungen versetzt, sodass nach Austritt aus der Flusszelle Tropfen vom bis dahin kontinuierlich fließenden Strom abreißen, die – selbst mit einer Ladung versehen – daraufhin in einem elektromagnetischen Feld vom Hauptstrom abgelenkt werden können. Die Größe der Tropfen und damit auch die Geschwindigkeit ihrer Generierung wird durch die Größe der Austrittsöffnung – der Düse oder Nozzle – bestimmt. Je kleiner die Düse, desto kleiner die Tropfen, desto schneller ihre Entstehung und auch die Sortierung. Diesen Tropfen wird unmittelbar am Abrisspunkt je nach gewünschter Auffangposition und dazu benötigtem Ablenkwinkel eine mehr oder weniger große Ladung verliehen. Im elektromagnetischen Spannungsfeld zwischen zwei gegensätzlich geladenen Ablenkplatten fliegen diese Tropfen mit den enthaltenen Zellen zu ihren jeweiligen Auffangröhrchen oder Plattenlöchern oder auf Objektträger (Abb. 1.1).
Neben dieser elektrostatischen Art der Sortierung gibt es auch mechanische Sortiermechanismen, bei denen die zu sortierenden Partikel mit einem Fangröhrchen eingesammelt werden (BD FACSCaliburTM) oder mit Hilfe eines akustischen Pulses abgelenkt werden (Partec). Die mechanische Variante hat die Vorteile, dass man mit dieser sanften Methode auch empfindliche Zellen sortieren kann, diese Art der Sortierung keine Aerosole produziert und im geschlossenen System keine Umweltkontaminationen in die Probe eindringen können. Nachteile sind die geringere Sortiergeschwindigkeit, die Verdünnung der sortierten Zellen und die Beschränkung auf eine zu sortierende Zellpopulation.
1.2.2Optik
Für das Durchflusszytometer sind Charakteristika biologischer Einzelzellen oder ähnlich großer Partikel als optische Eigenschaften wie Streu- und Fluoreszenzlicht detektierbar.
Das optische System eines Durchflusszytometers besteht aus der Anregungsseite und der Detektionsseite. Die typischerweise zur Anregung von Fluoreszenz bei der Durchflusszytometrie benutzten Laser strahlen Licht der folgenden Wellenlängen ab (s. Abb. 1.3).
Abb. 1.3: Gängige Anregungswellenlängen in der Durchflusszytometrie.
Über Prismen oder Zylinderlinsen wird aus dem runden Laserstrahl ein elliptischer Strahl geformt, der mit Hilfe einer Sammellinse in einem Punkt im Probenstrom gebündelt wird, um dort auf die fokussierten Zellen zu treffen (Interrogation Point – Analysepunkt; Abb. 1.4).
Ein elliptisches Strahlprofil ist in mehrerlei Hinsicht besser als ein rundes. Zum einen leuchtet ein solcher Strahl den ganzen Kernstrom aus, sodass Zellen auch dann gleichmäßig beleuchtet werden, we...